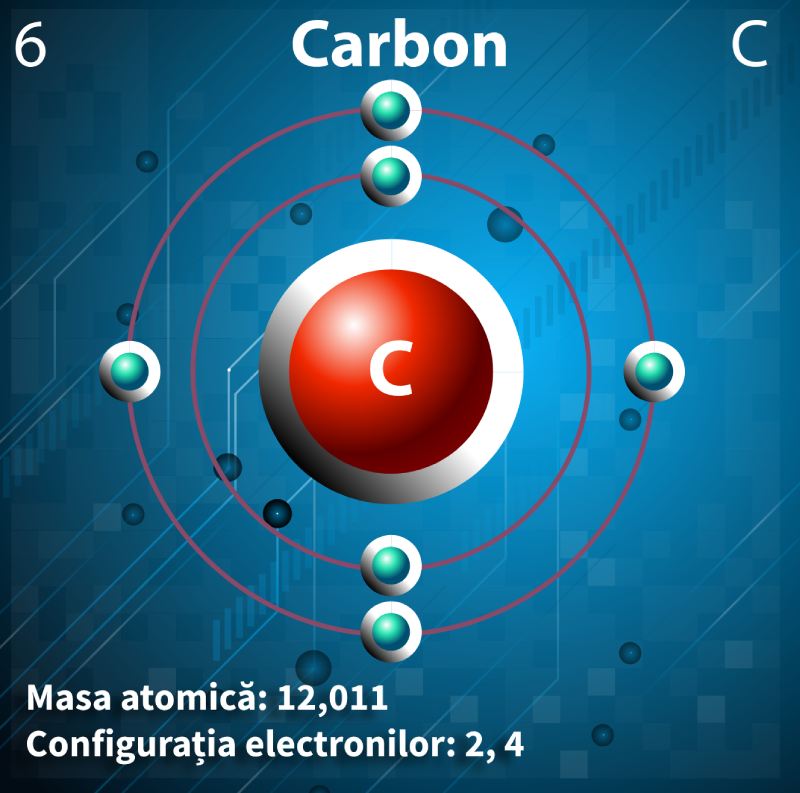
Atomul de carbon
Să luăm cazul atomului de carbon, că tot stă el la baza vieții pe Pământ (pentru că are 4 electroni pe ultimul strat electronic și poate forma legături chimice cu alți patru atomi). Este, un atom de carbon identic cu orice alt atom de carbon din univers? Nu neapărat. Iată care ar putea fi diferențele.
Electronii
Electronii oricărui atom sunt aranjați în straturi energetice în jurul nucleului (straturi care nu sunt necesarmente fizice, dat fiind că poziția electronilor este bazată prin calcularea funcției de undă, fiind o sumă de probabilități). Despre cum se aranjează electronii am scris recent un articol.
Ca să revenim o secundă la atomul de carbon, acesta are în forma sa fundamentală următoarea configurație electronică: 1s22s22p2 (în albastru este menționat substratul). Cei patru electroni din stratul 2 sunt electronii de valență ai elementului (care sunt implicați în formarea legăturilor chimice).
Electronii de pe ultimul strat se pot afla în stări excitate, în sensul că aceștia pot absorbi și elibera fotoni. Când primesc energie, aceștia trec pe un strat energetic superior. Imediat electronii revin pe stratul anterior, eliberând energie (fotoni).
Atomii în stări diferite au un comportament chimic diferit.
Izotopii
Atomii au nucleul format din protoni și neutroni. Atunci când numărul de neutroni este diferit de cel „standard” (nr. de protoni), atomul se numește „izotop”. Mai multe poți citi în articolul nostru: Ce este un izotop?
Nucleul unui atom obişnuit de carbon conţine 6 protoni şi 6 neutroni. Dar, în medie, unul din 100 de atomi de carbon are un neutron în plus. Acest fapt are efecte neglijabile în ceea ce priveşte proprietăţile carbonului, acest izotop, carbon-13, comportându-se ca orice atom obişnuit de carbon. Sigur, are o masă ușor mai mare dată de neutronul suplimentar.
Sigur ați auzit și de carbon-14, un alt izotop al carbonului, folosit în datarea obiectelor. Acesta se formează în atmosfera superioară în urma ciocnirilor dintre razele cosmice de înaltă energie şi atomii de azot, proces în urma căruia azotul devine carbon-14. Vă amintiți probabil că identitatea unui atom (ce tip de element chimic este) este dată de numărul de protoni. Eliminarea unui proton dintr-un atom îi schimbă identitatea.
Carbonul-14 este identic din punct de vedere chimic cu carbonul obişnuit, dar nucleul acestuia este instabil. După un interval de timp care poate varia de la câteva zile la mii de ani, carbonul-14 se dezintegrează, redevenind azot.
Deci nu există doi atomi identici?
Este foarte greu de răspuns la această întrebare. Pentru că, dincolo de cele menționate mai sus, mai sunt o mulțime de variabile care trebuie luate în calcul și care influențează comportamentul unui atom.
Contează viteaza pe care o are. Un atom de fier topit, de exemplu, are alt comportament decât un atom dintr-o bucată de fier la temperatura camerei.
Contează starea componentelor nucleului atomic. Amintesc faptul că nucleul atomic este format din mici particule fundamentale denumite quarcuri, care formează particule mai mari menționate mai sus, denumite protoni și neutroni. Diferențele stărilor nucleului se reflectă în comportamentul chimic al atomilor.
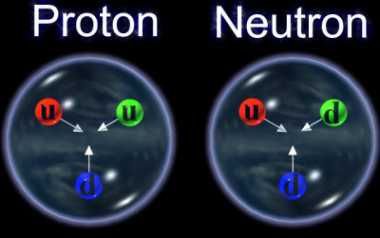
Narațiunea standard arată că un proton este alcătuit din trei quarcuri de două tipuri (două quarcuri up și un quarc down). Ca în imaginea de mai jos. Dar cercetări recente vin altă variantă.
Citește: Câte quarcuri sunt într-un proton?
După cum puteți observa, și atomii sunt tot atât de diferiți precum oamenii :) Suntem toți numiți la fel, atomi, oameni, dar fiecare are particularitățile sale care sunt evidențiate sau în nu, în funcție de contextul în care suntem plasați.
Credit imagine depositphotos.com
