 În cele ce urmează vom vorbi despre structura atomului, spectrometrul de masă, cât şi despre tabelul periodic al elementelor, cunoscut şi sub numele de ”Tabelul lui Mendeleev”, după numele chimistului rus care l-a construit în anul 1869.
În cele ce urmează vom vorbi despre structura atomului, spectrometrul de masă, cât şi despre tabelul periodic al elementelor, cunoscut şi sub numele de ”Tabelul lui Mendeleev”, după numele chimistului rus care l-a construit în anul 1869.
I. Definiţiile elementului chimic, atomului şi a compusului chimic
Un element chimic este o substanţă care nu poate fi descompusă mai departe în două sau mai multe substanţe.
Atomul este cea mai mică particulă, neutră din punct de vedere electrică, care compune un element chimic şi păstrează proprietăţile chimice ale elementului respectiv.
Un compus chimic este format din două sau mai multe elemente chimice.
II. Structura atomului
Am văzut ce este un atom. Acum haideţi să vedem din ce este compus un atom.
Atomii sunt compuşi din protoni, neutroni şi electroni. Protonii sunt situaţi în nucleul atomului şi au sarcină electrică pozitivă. Şi neutronii sunt situaţi tot în nucleu, dar aceştia nu au sarcină electrică. Protonii şi neutronii mai sunt cunoscuţi şi sub denumirea de nucleoni. Electronii formează un larg nor electronic ce înconjoară nucleul. Aceştia sunt de aproximativ 1800 de ori mai puţin masivi decât protonii şi neutronii. Electronii au sarcină electrică negativă.
Desigur, protonii şi neutronii sunt formaţi din particule subatomice mai mici, dar acest lucru nu afectează felul în care atomii se comportă în reacţiile chimice, deci nu vom trata acest aspect în cadrul acestei prezentări. Configuraţia electronică este cea care stabileşte cum se comportă un atom în cadrul unei reacţii chimice. Atomii unui element cedează, donează sau pun în comun electroni cu alţi atomi în timpul reacţiei. Numărul de protoni nu este niciodată afectat într-o reacţie chimică. Dacă numărul protonilor dintr-un atom s-ar schimba, atunci atomul ar deveni un atom al altui element chimic. Acest lucru nu se întâmplă în reacţiile chimice.
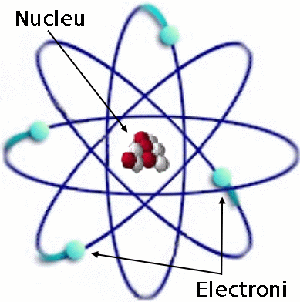
Imaginea unui atom al elementului beriliu, cu patru electroni şi patru protoni. Pe imagine sunt indicaţi electronii ce orbitează nucleul, precum şi nucleul atomic format din protoni şi neutroni.
III. Izotopii
Atomii sunt caracterizaţi prin două numere. Numărul atomic Z (numărul protonilor din nucleu) şi numărul de masă A (numărul nucleonilor).
Izotopii sunt specii ale aceluiaşi atom, ce au numărul atomic egal, dar un număr de masă diferit. Ei au un număr diferit de neutroni în nucleu. Izotopii aceluiaşi atom au proprietăţi chimice identice, dar au proprietăţi fizice diferite.
IV. Spectrometrul de masă
Masele atomilor, moleculelor şi fragmentelor de molecule pot fi măsurate cu ajutorul spectrometrului de masă.
Tot aerul din spectrometru este pompat afară mai întâi. Apoi o mostră a unui element sau compus, aflată în stare gazoasă, este introdusă în spectrometrul de masă. Este bombardată cu electroni pentru ca atomii ce o compun să fie transformaţi în ioni pozitivi. Apoi, ionii sunt acceleraţi de un câmp electric, iar mai apoi traiectoria lor este schimbată de un câmp magnetic. Odată schimbată traiectoria ionilor, începe detectarea lor. Ionii cu masă mai mică sunt detectaţi primii. Detectorul este conectat la un calculator care calculează raportul dintre masa şi sarcina fiecărui ion, precum şi abundenţa sa relativă faţă de cea a celui mai abundent ion. Aceasta este convertită într-un procent pentru fiecare ion.
Spectrometrele de masă sunt folosite şi în datarea cu carbon-14 sau sunt trimise în spaţiu, la bordul sondelor spaţiale, pentru a studia compoziţia atmosferei diverselor corpuri cereşti.
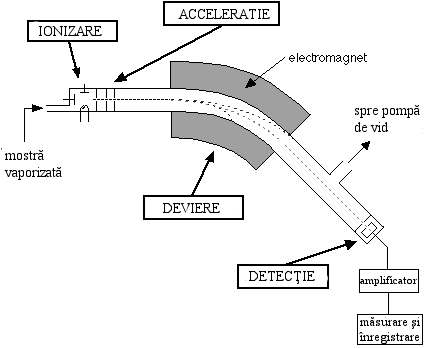
Imagine a unui spectrometru de masă
V. Configuraţia electronică
Configuraţia electronică a unui atom descrie aranjarea electronilor săi în diferiţi orbitali. Un orbital este pur şi simplu acel loc din spaţiu unde este cel mai probabil să găsim un electron. Se cunosc patru feluri de orbitali: s, p, d şi f. Forma orbitalilor de tip d şi f este destul de complexă şi nu este studiată la nivel de liceu. Dar forma orbitalilor de tip s şi p trebuie cunoscută.
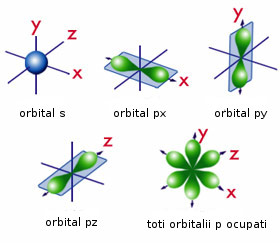
Imagine cu forma orbitalilor s şi p.
VI. Tabelul periodic al elementelor
Înţelegerea tabelului periodic al elementelor, construit de chimistul rus Mendeleev, este necesară pentru înţelegerea chimiei. Tabelul este compus din 18 grupe şi 7 perioade.
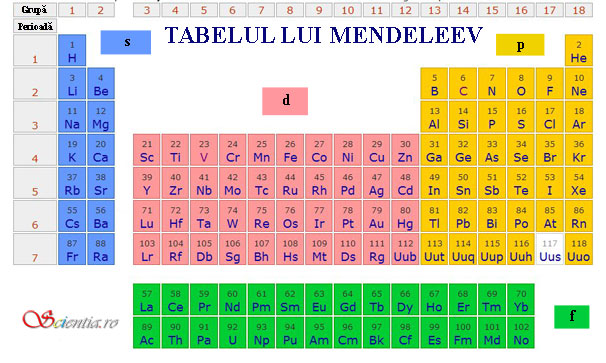
a. Grupele
Grupele sunt coloanele verticale din tabel. În grupe, elementele au proprietăţi similare sau chiar identice. Primele două grupe formează blocul de elemente s. Aceste elemente au ultimul electron într-un orbital de tip s. Prima grupă este grupa metalelor alcaline, iar cea de-a doua este grupa metalelor alcalino-pământoase. Elementele din grupele III-XII formează blocul elementelor d, având ultimul electron într-un orbital de tip d. Acestea sunt grupele metalelor tranziţionale. Elementele din grupele XIII-XVIII formează blocul elementelor p, elemente ce au ultimul electron într-ul orbital de tip p. Grupa a XVII-a este cunoscută ca şi grupa halogenilor, iar ultima grupă, a XVIII-a, este grupa gazelor rare sau nobile. Acestea din urmă sunt foarte slab reactive, având ultimul strat electronic complet. Astfel, ele nu au nevoie nici să cedeze, nici să primească electroni pentru a avea ultimul strat complet. Desigur, există şi un bloc al elementelor cu ultimul electron într-un orbital de tip f, acestea sunt lantanidele şi actinidele. Ele sunt trecute sub tabelul periodic. Lantanidele sunt cunoscute ca şi pământuri rare, iar actinidele ca şi pământuri rare radioactive.
b. Perioadele
Perioadele sunt liniile orizontale din tabel. Elementele dintr-o perioadă au acelaşi număr de straturi de electroni.
