Legătura covalentă se defineşte ca fiind atracţia electrostatică dintre o pereche de electroni pusă în comun de doi atomi şi nucleele atomilor. De cele mai multe ori, o legătură covalentă e reprezentată printr-o linie între cei doi atomi.
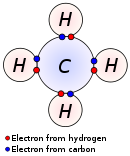
credit imagine: Wikimedia Commons
Imagine a unei molecule de metan, CH4, formată dintr-un atom de carbon şi patru atomi de hidrogen. Între atomii de hidrogen şi cel de carbon există legături covalente.
Legăturile covalente sunt de mai multe feluri:
1. Legătura covalentă nepolară
Această legătură se formează între atomii de acelaşi fel sau între atomi cu electronegativităţi foarte apropiate. Fiecare atom pune în comun câte un electron. Perechea de electroni e împărţită în mod egal de cei doi atomi.
2. Legătură covalentă polară
Se formează între atomi ai nemetalelor din specii diferite. Aceşti atomi au electronegativităţi diferite. La fel, fiecare atom pune în comun câte un electron pentru a forma legătura. Perechea de electroni e atrasă mai mult către atomul mai electronegativ.
3. Legătura covalentă coordinativă
Este un caz mai special al legăturii covalente, de această dată ambii electroni venind de la acelaşi atom. Atomul care ”donează” perechea de electroni se numeşte donor, iar atomul care o acceptă se numeşte acceptor.
Legăturile covalente sunt foarte puternice. Ca să vă convingeţi de acest lucru, gândiţi-vă doar la cât de dur este diamantul. Ei bine, diamantul este alcătuit din atomi de carbon, aşezaţi în formă de tetraedru, fiecare atom de carbon formând patru legături covalente cu alţi atomi de carbon.
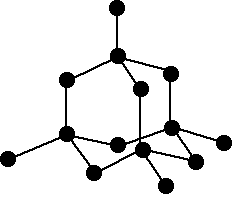
credit imagine: http://www.chemguide.co.uk
Structura moleculei de diamant
