
Atomul de hidrogen, format dintr-un proton şi un electron
Izotopul este specia de atom cu același număr atomic Z, dar cu număr de masa A diferit (adică aceleași proprietăți chimice, dar proprietăți fizice diferite).
Numărul atomic se referă la numărul de protoni din nucleu. Numărul de protoni este cel care dă identitatea unui element chimic. De exemplu, hidrogenul, cel mai simplu atom, are un singur proton.
Izotopii se diferenţiază între ei prin numărul de neutroni (particula neutră din compunerea nucleului atomic).
Iată cazul celui mai simplu atom, atomul de hidrogen. Hidrogenul are trei izotopi care apar în mod natural, notaţi ca 1H, 2H, and 3H.
:: izotopul hidrogenului cu niciun neutron se numește protiu (stabil)
:: izotopul hidrogenului cu 1 neutron se numește deuteriu (stabil)
:: izotopul hidrogenului cu 2 neutroni se numește tritiu (radioactiv)
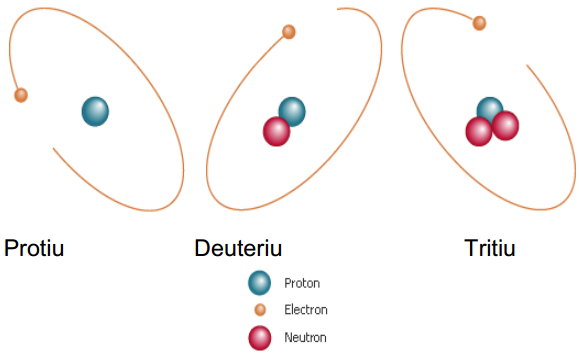
Izotopii hidrogenului
Termenul „zotop” provine din grecescul isos (egal) și topos (loc).
Este, aşadar, de reţinut că:
:: toți izotopii unui element chimic au în învelișul electronic același număr de electroni;
:: nucleele lor au același număr de protoni;
:: diferit este numărul de neutroni.
În nomenclatura științifică, izotopii unui element se scriu prin adăugarea unei cratime între numele elementului și numărul său de masă, astfel: heliu-3, carbon-12, carbon-14, uraniu-238, iar prescurtat se notează folosind simbolul elementului și numărul de masă în partea stângă sus: 3He, 12C, 14C, 238U.
Sursa: wikipedia.org
