Virusurile și gazdele lor sunt într-o continuă stare de război evoluționist. Organismele gazdă încearcă să găsească moduri de a scăpa de intrușii lor parazitari, în timp ce virusurile apelează la contramăsuri pentru a evita respingerea.
Este o cursă cu arme biologice care scoate adesea la iveală niște inovații destul de ciudate. Însă cercetătorii de la Universitatea Tufts au descoperit recent o adaptare pe care n-au putut-o descrie decât ca fiind ”remarcabilă”: un virus care capturează sistemul imunitar al gazdei, pe care îl folosește apoi pentru un viitor atac.
Studiul, pe care îl puteți găsi în Nature, este primul care a arătat că un virus, în acest caz un bacteriofag, poate dobândi un sistem imunitar complet funcțional și adaptiv. E o descoperire care amenință să complice dezbaterea asupra naturii virusurilor - o formă de viață sau pur și simplu secvențe complexe de ADN sau ARN?
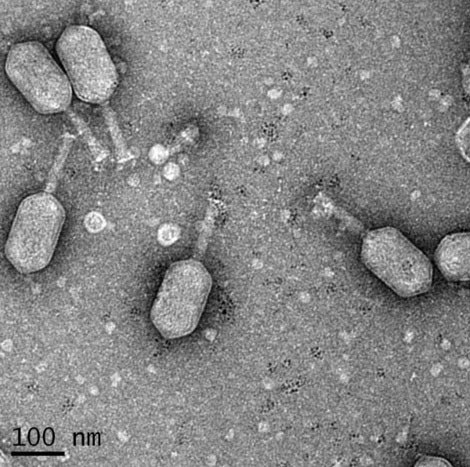
Descoperirea a fost făcută de Andrew Camilli, Kimberley Seed și colegii lor în timp ce analizau secvențe ADN de bacteriofagi – mai exact ICP1 – extrase din mostre de scaun de la pacienți suferind de holeră (Vibrio cholerae). Spre surprinderea lor, aceștia au găsit în fag un set de gene numite CRISPR/Cas, caracteristice unui sistem imunitar complet funcțional – un fel de sistem imunitar întâlnit doar la unele bacterii (și la majoritatea speciilor de Archaea, un grup de microorganisme unicelulare aparte de cele cinci regnuri).
Ei au decis să verifice descoperirea, luând un bacteriofag care nu avea sistemul imunitar adaptiv și eliberându-l împotriva unei alte secvențe de bacterii ale holerei, care e în mod natural imună la el. Bacteriofagul a dat greș. Apoi, au luat bacteriofagul ”îmbunătățit” CRISPR/Cas și l-au eliberat împotriva acelorași bacterii ale holerei – însă, de această dată, el s-a adaptat și a dobândit abilitatea de a infecta (și de a ucide) bacteriile de holeră.
Ceea ce nu este neapărat un lucru rău. Vorbim, la urma urmei, despre bacteriile care dau naștere holerei.
În mare, CRISPR/Cas este folosit de bacteriofag pentru a se adapta și a învinge sistemele de apărare ale bacteriilor de holeră. În mod normal, CRISPR/Cas oferă protecție specifică pentru anumite secvențe în fața acizilor nucleici invadatori, inclusiv a bacteriofagilor. Dar, în ceea ce privește ICP1, asta a fost o întorsătură de situație neobișnuită.
Înarmat cu sistemul imunitar al gazdei sale, bacteriofagul poate ucide bacteriile de holeră și se poate multiplica, producând mai mulți bacteriofagi, care vor ucide mai departe mai multe bacterii de holeră. El face asta identificând și distrugând genele inhibitoare specifice ale celulei gazdă ”tăind în bucăți” genele țintă. Dezarmând aceste gene, bacteriofagul poate dezarma și celulele gazdă, reușind să le infecteze și să le omoare. În linii mari, bacteriofagul utilizează sistemul imunitar CRISPR pentru a ataca genele atacatoare de virusuri ale gazdei sale.
Înaintea acestui studiu, cercetătorii credeau că virusurile sunt prea rudimentare sau primitive pentru a avea propriul lor sistem imunitar.
Este important să menționăm, totuși, că bacteriofagul nu ”produce” cu adevărat propriul său sistem imunitar; nu are capacitățile genetice necesare pentru asta. În schimb, trebuie să captureze unul, parazitând practic genomul altui organism. Dacă acesta reprezintă sau nu o formă veritabilă de viață rămâne o întrebare deschisă (și posibil fără de răspuns).
Însă descoperirea este interesantă și prin aceea că ar putea conduce la dezvoltarea terapiei cu bacteriofagi – utilizarea bacteriofagilor pentru a trata bolile bacteriane. Dată fiind apariția bacteriilor rezistente la antibiotice, o terapie cu bacteriofagi creată genetic s-ar putea dovedi a fi intervenția pe care o așteptam cu toții. Dar, în ceea ce privește bacteriofagul, asta ar însemna război.
Traducere de Ana Cristina Dumitrache după this-virus-has-its-very-own-immune-system cu acordul editorului
