Leonard Hayflick este unul dintre cei mai influenți biologi ai secolului XX, cunoscut pentru faptul că a schimbat radical înțelegerea noastră despre celulele umane și îmbătrânire. Hayflick a demonstrat, pentru prima dată, că celulele umane nu sunt nemuritoare, contrazicând teoriile anterioare. Contribuțiile sale nu se limitează doar la acest domeniu; de-a lungul carierei sale, a contribuit în mod esențial în microbiologie, studiul cancerului și gerontologie.
Descoperirea sa fundamentală este cunoscută sub numele de „Limita Hayflick”, și vom vorbi imediat despre ce înseamnă această limită, precum și despre implicațiile acestei limite pentru industria modernă a longevității și medicina anti-îmbătrânire.
Hayflick a murit pe 1 august 2024, iar NYTimes i-a dedicat un scurt articol, care poate fi citit gratuit aici.
Contextul științific dinaintea descoperirii lui Hayflick
În anii '50, cercetătorii credeau că celulele umane normale s-ar putea diviza la nesfârșit, similar celulelor canceroase. Acest concept era susținut de lucrările lui Alexis Carrel, un renumit chirurg și biolog francez, care pretindea că celulele țesutului de pui cultivate în laborator erau practic nemuritoare. Carrel susținea că celulele își mențineau capacitatea de a se divide nelimitat dacă erau cultivate în condiții adecvate. Teoria sa a influențat puternic biologia celulelor pentru decenii întregi, însă era bazată pe o metodologie greșită, pe care Hayflick avea să o demonteze.
Descoperirea „Limitei Hayflick”
În 1961, Leonard Hayflick, lucrând la Wistar Institute din Philadelphia împreună cu Paul Moorhead, a efectuat o serie de experimente care au dus la o descoperire revoluționară. Hayflick a observat că celulele umane diploide normale (celule care au două seturi complete de cromozomi, adică cele care nu sunt canceroase) au o capacitate limitată de diviziune. După un anumit număr de diviziuni, aceste celule intrau într-o stare denumită „senescență replicativă” și nu mai puteau să se dividă. El a estimat că celulele umane se pot diviza de aproximativ 40-60 de ori, numărul exact variind în funcție de tipul de celulă și de condițiile experimentale.
Celulele somatice umane sunt diploide și conțin două seturi haploide de cromozomi, fiecare set haploid format din 23 de cromozomi, câte unul din fiecare pereche. Cei 46 cromozomi se împart în 22 de perechi de cromozomi identici la bărbați și la femei numiți autozomi, plus o pereche de cromozomi sexuali (numiți și heterozomi sau gonozomi), identici la femei (XX) și diferiți la bărbați (XY).
Această descoperire, cunoscută sub numele de „Limita Hayflick”, a fost extrem de controversată la momentul respectiv, deoarece contrazicea ipoteza nemuririi celulare promovată de Carrel. Hayflick a sugerat că îmbătrânirea celulară este un proces natural și inevitabil, determinat de un ceas intern genetic care limitează numărul de diviziuni.
Mecanismul molecular din spatele Limitei Hayflick
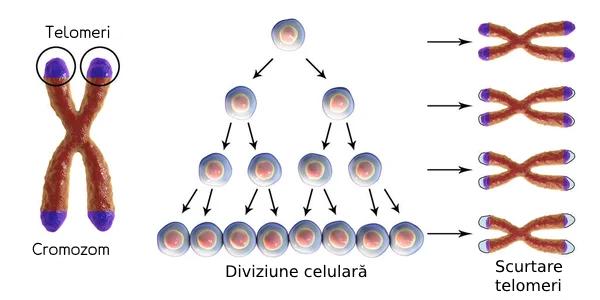
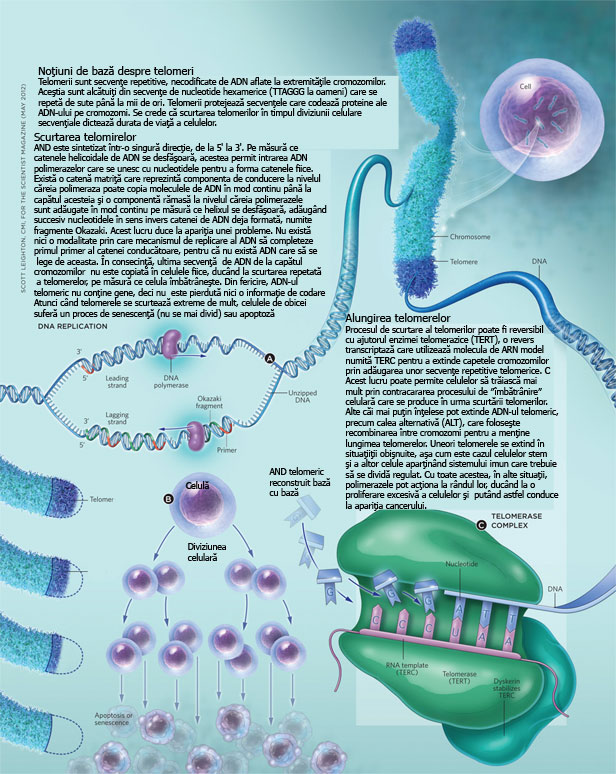
Cercetările ulterioare au arătat că mecanismul din spatele acestei limite este legat de structurile numite „telomeri”. Telomerii sunt capetele cromozomilor care protejează ADN-ul de degradare în timpul replicării celulare. La fiecare diviziune celulară, telomerii devin tot mai scurți, iar atunci când ating o lungime critică, celulele intră în senescență și nu se mai divid.
Hayflick nu a identificat acest mecanism în mod direct, însă descoperirile sale au deschis calea pentru cercetările ulterioare, care au relevat importanța telomerilor și a enzimei telomerază în menținerea longevității celulare. De exemplu, s-a descoperit că celulele canceroase exprimă niveluri ridicate de telomerază, ceea ce le permite să mențină lungimea telomerilor și să evite senescența, contribuind astfel la caracterul lor „nemuritor”.
Rolul telomerilor în îmbătrânirea celulară
Telomerii sunt esențiali pentru protecția ADN-ului și stabilitatea genomică. Fiecare diviziune celulară reduce lungimea telomerilor, ceea ce duce în cele din urmă la pierderea acestei protecții și la intrarea celulelor în senescență. În timp ce descoperirea lui Hayflick a explicat limitele diviziunii celulare, a rămas întrebarea: cum reușesc anumite celule să depășească această limită?
Aici intervine enzima telomerază, o enzimă descoperită în 1984 de Elizabeth Blackburn și Carol Greider, care are capacitatea de a repara telomerii.
Telomeraza menține lungimea telomerilor în anumite celule, cum ar fi celulele stem și celulele germinale, permițându-le să se dividă în mod continuu fără a atinge limita impusă de scurtarea telomerilor. În aceste celule, activitatea telomerazei este esențială pentru regenerarea tisulară pe termen lung, cum ar fi în măduva osoasă, unde se formează constant noi celule sanguine.
Alte contribuții științifice ale lui Leonard Hayflick
Pe lângă descoperirea limitei celulare, Hayflick a avut contribuții semnificative și în alte domenii ale biologiei. Printre acestea se numără cercetările sale asupra culturilor celulare, dar și dezvoltarea unor linii de celule umane care au devenit esențiale în cercetarea medicală și dezvoltarea de vaccinuri.
Una dintre realizările sale importante a fost izolarea și stabilizarea celulelor fibroblaste umane diploide, cunoscute sub numele de „WI-38”. Această linie celulară, derivată din țesut pulmonar de fetus uman, a fost utilizată pe scară largă în dezvoltarea vaccinurilor împotriva unor boli precum poliomielita, rujeola, rubeola și rabia. Aceste culturi de celule umane au permis producerea sigură și eficientă a vaccinurilor, salvând milioane de vieți.
De asemenea, Hayflick a fost un pionier în domeniul gerontologiei, studiul îmbătrânirii. A contribuit la dezvoltarea unei noi înțelegeri a modului în care celulele și țesuturile îmbătrânesc, ceea ce a dus la o reevaluare a teoriilor despre îmbătrânirea umană. Prin aceste contribuții, Hayflick a avut un impact major asupra biologiei celulare și medicinei, iar munca sa a influențat generații de cercetători.
Descoperirea lui Hayflick și industria modernă a longevității
Descoperirea limitei celulare a avut implicații profunde pentru înțelegerea îmbătrânirii, ceea ce a alimentat un întreg domeniu de cercetare în medicina anti-îmbătrânire. În ultimii ani, industria longevității a devenit un domeniu emergent în biotehnologie, concentrându-se pe găsirea de soluții pentru prelungirea vieții umane și combaterea efectelor îmbătrânirii.
Însă, deși descoperirea lui Hayflick sugerează că îmbătrânirea este inevitabilă la nivel celular, mulți cercetători și antreprenori din domeniul longevității încearcă să depășească aceste limite prin diverse abordări. Una dintre principalele direcții este prelungirea vieții celulare prin manipularea telomerilor. O ipoteză este că, prin menținerea lungimii telomerilor cu ajutorul telomerazei, am putea prelungi durata de viață a celulelor și, în consecință, a organismului.
Tehnologiile bazate pe telomerază și controversele
Descoperirea telomerazei a stârnit un val de optimism în comunitatea științifică și în rândul publicului larg în ceea ce privește posibilitatea prelungirii vieții. Teoretic, activarea telomerazei în celulele somatice ar putea preveni scurtarea telomerilor și, astfel, amâna senescența celulară, contribuind la regenerarea tisulară pe termen lung și prevenind bolile legate de vârstă. Acest lucru a dus la o explozie de cercetări în domeniul terapiilor anti-îmbătrânire, cu scopul de a găsi metode de activare controlată a telomerazei.
În 2010, un studiu condus de María Blasco a demonstrat că șoarecii modificați genetic pentru a avea activitate telomerazică crescută au trăit mai mult și au prezentat o rezistență mai bună la boli legate de îmbătrânire. Cu toate acestea, studiul a subliniat și riscul apariției cancerului la aceste organisme, arătând că beneficiile potențiale ale prelungirii vieții trebuie cântărite cu atenție în raport cu riscurile.
În ciuda entuziasmului din jurul telomerazei, activarea acestei enzime vine cu riscuri. Studiile arată că activitatea excesivă a telomerazei este asociată cu creșterea tumorilor canceroase, deoarece permite celulelor să evite senescența și să continue să se dividă. În acest sens, prelungirea vieții celulare poate crește riscul de cancer, ceea ce reprezintă o provocare majoră pentru dezvoltarea terapiilor sigure și eficiente.
Pe lângă cercetările privind telomerii, alte abordări includ terapia genică, regenerarea tisulară și utilizarea celulelor stem. Companii precum Calico (deținută de Google) și Unity Biotechnology lucrează pentru a dezvolta medicamente care să încetinească sau chiar să inverseze procesele de îmbătrânire la nivel celular. De asemenea, se studiază senoliticele, compuși care elimină celulele senescente din organism, reducând astfel efectele negative ale acumulării acestora.
În ciuda riscurilor, viitorul cercetării asupra telomerazei este promițător. Dezvoltarea unor tehnologii de editare genetică, precum CRISPR-Cas9, ar putea permite o manipulare mai precisă a expresiei telomerazei, reducând riscurile asociate cu cancerul. În același timp, cercetările asupra mecanismelor alternative de extindere a telomerilor (ALT) în celulele tumorale oferă noi perspective asupra modului în care ar putea fi controlată proliferarea celulară.
În acest context, descoperirea lui Hayflick servește drept o bază esențială pentru înțelegerea acestor procese, însă deschide și întrebări fundamentale: este îmbătrânirea un proces inevitabil sau poate fi depășit prin intervenție biotehnologică?
Longevitatea - întrebări de natură etică
Pe măsură ce cercetările în domeniul longevității avansează, apar și întrebări etice și filosofice legate de prelungirea vieții umane. De exemplu, cât de mult ar trebui să fie extinsă viața? Ce impact ar avea aceste tehnologii asupra societății? În ce măsură ar trebui limitate la un grup select de indivizi sau ar trebui să fie accesibile tuturor? Aceste probleme complexe reflectă tensiunea dintre promisiunile biotehnologiei și provocările sale etice.
În plus, există și discuții despre echitatea în accesul la aceste tratamente. Întrebările despre cine ar beneficia de extinderea vieții și cum ar afecta acest lucru societatea sunt centrale în discuția despre longevitate. Prelungirea vieții ar putea crea noi forme de inegalitate socială, mai ales dacă doar elitele ar avea acces la aceste tratamente. În plus, există îngrijorări legate de impactul demografic și ecologic al unei populații globale care trăiește semnificativ mai mult. O creștere semnificativă a speranței de viață ar putea duce la probleme de suprapopulare și resurse limitate, ceea ce ar amplifica deja presiunile existente asupra mediului și economiei globale.
Longevitate cu orice preț. Impactul asupra industriei de sănătate și economiei
Pe lângă implicațiile etice și sociale, prelungirea vieții ar avea un impact profund asupra economiei și industriei de sănătate. Cu o populație în vârstă care trăiește mai mult, sistemele de sănătate și de pensii ar trebui reconfigurate pentru a face față noilor realități. Creșterea numărului de persoane în vârstă ar putea pune presiune pe serviciile de sănătate, care ar trebui să facă față unei cereri mai mari pentru îngrijiri pe termen lung și tratamente costisitoare.
De asemenea, s-ar putea pune problema duratei de muncă, întrucât oamenii ar putea fi nevoiți să muncească mai mult timp pentru a-și susține existența în timpul vieții prelungite.
Totodată, există potențialul ca terapiile legate de longevitate să devină o industrie profitabilă, atrăgând investiții uriașe din partea companiilor farmaceutice și biotehnologice. Cu toate acestea, dacă aceste tratamente rămân extrem de scumpe, s-ar putea crea o piață elitistă, ceea ce ar accentua și mai mult discrepanțele între cei care își permit să își prelungească viața și restul populației.
În ciuda optimismului din jurul cercetărilor asupra longevității, există voci critice care sugerează că aceste eforturi ar putea fi greșite sau chiar periculoase. Unii cercetători susțin că prelungirea vieții umane fără a rezolva simultan problemele legate de sănătate și calitatea vieții ar putea duce la o perioadă extinsă de suferință și boală la vârste avansate.
De asemenea, criticii subliniază că îmbătrânirea este un proces natural și inevitabil, care are o funcție biologică importantă. Într-o perspectivă evoluționistă, îmbătrânirea ajută la eliminarea organismelor mai vechi și la deschiderea spațiului pentru generațiile mai tinere, promovând astfel evoluția speciei. Încercările de a evita îmbătrânirea ar putea contrazice aceste principii fundamentale ale naturii.
Rolul descoperirii lui Hayflick în înțelegerea longevitații
În acest context, descoperirea „Limitei Hayflick” rămâne centrală pentru înțelegerea procesului de îmbătrânire. Leonard Hayflick a arătat că, la un anumit nivel, îmbătrânirea este un fenomen inevitabil pentru celulele umane normale. Cu toate că cercetările ulterioare au identificat diverse mecanisme care influențează acest proces, inclusiv telomerii și telomeraza, mesajul de bază al lucrării lui Hayflick este că celulele nu pot funcționa la nesfârșit fără a suferi degradări.
În același timp, această descoperire a deschis calea pentru investigarea diferitelor modalități de a întârzia senescența celulară și de a prelungi durata de viață a celulelor, fie prin manipularea telomerilor, fie prin eliminarea celulelor senescente. Cercetările inspirate de Hayflick sunt astăzi la baza numeroaselor studii privind intervențiile anti-îmbătrânire și a dezvoltării unor tehnologii care promit să prelungească viața umană sănătoasă.
Un alt pericol este apariția unor soluții nesigure sau nevalidate științific care să fie vândute ca „elixire ale vieții”. Istoria a arătat că oamenii sunt predispuși să caute soluții rapide pentru a prelungi viața sau a evita îmbătrânirea, ceea ce poate deschide calea pentru escrocherii sau tratamente neautorizate care pot avea consecințe nefaste.
Cum putem preveni scurtarea telomerilor?
Prevenirea scurtării telomerilor este un subiect intens studiat, deoarece scurtarea lor este asociată cu îmbătrânirea celulară și diverse boli legate de vârstă. Deși scurtarea telomerilor este un proces natural care se întâmplă cu fiecare diviziune celulară, există anumite strategii care pot încetini acest proces și care sunt bazate pe cercetări științifice.
Iată câteva dintre metodele propuse:
1. Stil de viață sănătos
Adoptarea unui stil de viață sănătos este unul dintre cei mai eficienți factori pentru menținerea telomerilor și prevenirea scurtării lor rapide.
Dieta echilibrată: O dietă bogată în alimente antiinflamatorii și antioxidante poate contribui la menținerea lungimii telomerilor. Consumul de legume, fructe, cereale integrale, nuci și semințe este recomandat pentru a proteja telomerii de daune oxidative. Acizi grași omega-3, regăsiți în peștele gras (somon, macrou), sunt, de asemenea, asociați cu telomeri mai lungi.
Antioxidanți precum vitamina C, vitamina E, polifenolii și alții ajută la neutralizarea radicalilor liberi care pot deteriora telomerii.
Acizi grași precum omega-3 din surse naturale sau suplimente a fost asociat cu telomeri mai lungi și o reducere a inflamației.
Exercițiile fizice regulate: Activitatea fizică moderată și regulată, precum mersul pe jos, jogging-ul, ciclismul sau alte tipuri de exerciții aerobice, poate preveni scurtarea accelerată a telomerilor. Studiile arată că exercițiile fizice ajută la reducerea inflamației și a stresului oxidativ, protejând telomerii.
2. Somn de calitate
Somnul insuficient sau de proastă calitate poate accelera scurtarea telomerilor. Pentru a proteja telomerii, este esențial să dormiți suficient și să vă asigurați că aveți un somn neîntrerupt și odihnitor. Un somn de calitate sprijină regenerarea celulară și reduce inflamația și stresul oxidativ. Iată câteva idei.
3. Menținerea unei greutăți sănătoase
Obezitatea este asociată cu scurtarea accelerată a telomerilor. Păstrarea unei greutăți sănătoase, printr-o combinație de alimentație echilibrată și exerciții fizice, poate contribui la prevenirea scurtării telomerilor. Obezitatea duce la inflamații și stres oxidativ, care pot deteriora telomerii.
4. Renunțarea la fumat și reducerea consumului de alcool
Fumatul este un factor puternic de scurtare a telomerilor, deoarece accelerează stresul oxidativ și inflamația în organism. Renunțarea la fumat sau evitarea acestuia poate contribui la protejarea telomerilor. Consumul excesiv de alcool poate, de asemenea, deteriora telomerii, astfel încât limitarea sau evitarea alcoolului este recomandată.
5. Reducerea inflamației
Inflamația cronică joacă un rol important în scurtarea telomerilor. Alimentele bogate în antioxidanți, acizii grași omega-3, exercițiile fizice și gestionarea stresului pot ajuta la reducerea inflamației și, implicit, la protejarea telomerilor.
Concluzii
Leonard Hayflick rămâne o figură centrală în înțelegerea procesului de îmbătrânire celulară. Descoperirea sa că celulele umane nu sunt nemuritoare a schimbat paradigmele în biologie și a pus bazele unei noi ramuri a cercetării în gerontologie și medicina longevității. Deși descoperirile ulterioare au nuanțat și extins această teorie, munca sa a rămas esențială în investigarea felului în care îmbătrânim și a modului în care am putea interveni pentru a prelungi durata de viață sănătoasă.
Industria modernă a longevității a evoluat rapid, alimentată de descoperiri în biotehnologie și genetică, dar și de dorința umană profundă de a prelungi viața. Însă, în această cursă pentru extinderea longevității, trebuie să păstrăm un echilibru între progresul științific și considerațiile etice și sociale. De asemenea, trebuie să fim conștienți de riscurile asociate manipulării telomerilor și celulelor și de provocările de a transforma aceste descoperiri în soluții accesibile și sigure pentru întreaga societate.
Munca lui Hayflick a arătat că îmbătrânirea este parte din natura noastră biologică, iar provocarea noastră actuală este să ne folosim cunoștințele pentru a îmbunătăți calitatea vieții, mai degrabă decât să căutăm nemurirea.
Credit prima imagine: depositphotos.com.
Credit a doua imagine: The Scientist.
Articol scris cu ajutorul IA.
