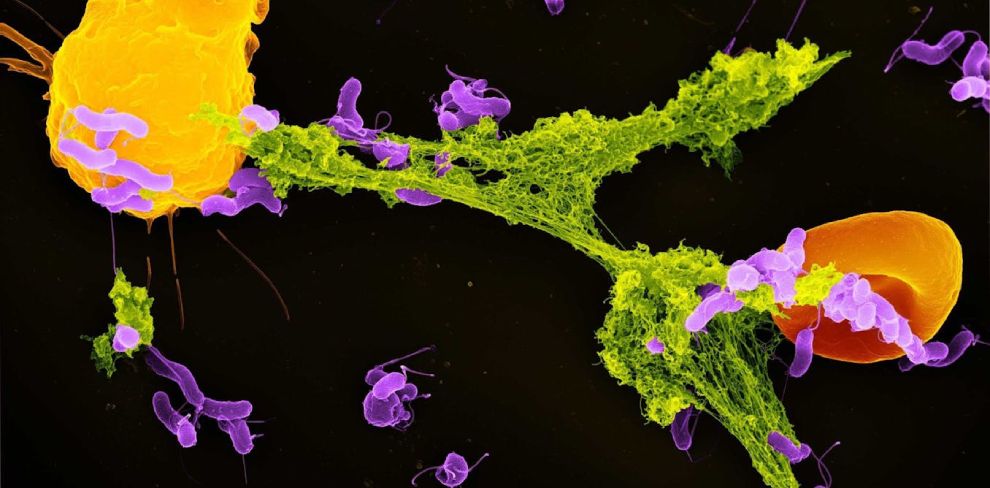
Neutrofilele (galbene) eliberează o capcană extracelulară (verde) pentru a prinde bacteriile (mov). Alte celule, precum globulele roșii (portocalii), pot fi și ele prinse în capcană.
Imagine: CHDENK/Wikimedia Commons
Mitocondriile sunt fost cunoscute în principal ca acele componente celulare care produc energie. Însă oamenii de știință descoperă că aceste mici organite fac mult mai mult decât atât. Ele sunt implicate și în funcții imunitare precum controlul inflamației, reglarea morții celulare și răspunsul la infecții.
Cercetările efectuate de mine și colegii mei au arătat că mitocondriile joacă un alt rol esențial în răspunsul imunitar: detectarea activității bacteriene și sprijinirea neutrofilelor – un tip de globule albe – să le captureze și să le distrugă.
Timp de 16 ani, cercetările mele s-au concentrat pe înțelegerea deciziilor pe care celulele imunitare le iau în timpul infecțiilor și pe modul în care disfuncțiile acestor procese decizionale pot duce la boli.
Cele mai recente descoperiri ale laboratorului meu oferă o explicație pentru dificultatea cu care persoanele cu boli autoimune, precum lupusul, luptă împotriva infecțiilor, sugerând o posibilă legătură între disfuncția mitocondrială și slăbirea apărării imunitare.
Armele secrete ale sistemului imunitar
Neutrofilele sunt cele mai numeroase celule ale sistemului imunitar și sunt primele care reacționează.
Unul dintre mecanismele lor de apărare esențiale este eliberarea așa-numitelor capcane extracelulare neutrofile sau NETs (neutrophil extracellular traps) – structuri asemănătoare unor pânze formate din ADN și proteine antimicrobiene. Aceste capcane lipicioase captează și neutralizează microbii invadatori, împiedicând răspândirea lor în organism.
Până de curând, oamenii de știință credeau că formarea lor este declanșată în principal de stres celular și vătămări. Totuși, studiul nostru a arătat că mitocondriile pot detecta un anumit produs secundar bacterian – lactatul – și folosesc acest semnal pentru a iniția formarea capcanelor.
Lactatul este adesea asociat cu oboseala musculară la oameni. Dar în contextul infecțiilor bacteriene, are un rol diferit. Multe bacterii eliberează lactat ca parte a propriului proces de producere a energiei. Echipa mea a descoperit că, odată ce bacteriile sunt înglobate într-un compartiment celular numit fagozom, neutrofilele pot detecta prezența acestui lactat.
În interiorul fagozomului, lactatul transmite neutrofilei semnalul că bacteriile sunt prezente și că procesele antibacteriene existente nu sunt suficiente pentru a le distruge. Când mitocondriile din neutrofile detectează acest lactat, ele încep să transmită semnale care determină celula să elimine capcanele extracelulare care au prins bacteriile. Odată ce bacteriile sunt eliberate în afara celulei, alte celule imunitare le pot distruge.
Când am blocat capacitatea mitocondriilor de a detecta lactatul, neutrofilele nu au mai produs capcanele menționate în mod eficient. Asta a însemnat că bacteriile aveau mai multe șanse să scape și să se înmulțească, ceea ce arată cât de important este acest mecanism pentru apărarea imunitară. Acest proces evidențiază un dialog complex între metabolismul bacterian și „mașinăria energetică” a celulei gazdă.
Ceea ce face această descoperire surprinzătoare este faptul că mitocondriile, aflate în interiorul celulei, pot detecta bacteriile aflate în fagozomi – chiar dacă microbii sunt izolați într-un spațiu separat. Cumva, senzorii mitocondriali pot prelua semnale din interiorul acestor compartimente – o realizare impresionantă de coordonare celulară.
Țintirea mitocondriilor pentru a combate infecțiile
Studiul nostru face parte dintr-un domeniu emergent numit „imunometabolism”, care explorează modul în care metabolismul și funcțiile imunitare sunt interconectate.
În loc să fie privit strict ca un mijloc de a genera energie, metabolismul celular este acum recunoscut ca un factor central care influențează deciziile imunitare.
Mitocondriile se află în centrul acestei interacțiuni. Capacitatea lor de a detecta, răspunde și chiar modela mediul metabolic al unei celule le oferă un rol critic în determinarea modului și momentului în care răspunsurile imunitare sunt activate.
De exemplu, descoperirile noastre oferă o explicație cheie pentru care pacienții cu o boală autoimună cronică numită „lupus eritematos sistemic” suferă frecvent de infecții recurente. Mitocondriile din neutrofilele acestor pacienți nu reușesc să detecteze corespunzător lactatul bacterian. Drept urmare, producția de capcane este semnificativ redusă. Această disfuncție mitocondrială ar putea explica vulnerabilitatea crescută a pacienților cu lupus la infecțiile bacteriene – chiar dacă sistemul lor imunitar este în permanență activat din cauza bolii.
Această observație subliniază rolul central al mitocondriilor în echilibrarea răspunsurilor imunitare. Ea conectează două probleme aparent fără legătură: hiperactivitatea imunitară, ca în lupus, și slăbiciunea imunitară, cum e susceptibilitatea crescută la infecții. Atunci când mitocondriile funcționează corect, ele ajută neutrofilele să inițieze un atac eficient și direcționat asupra bacteriilor. Dar când mitocondriile sunt afectate, acest sistem se prăbușește.
Descoperirea noastră că mitocondriile pot detecta lactatul bacterian pentru a declanșa formarea capcanelor extracelulare deschide noi posibilități pentru tratarea infecțiilor.
De exemplu, medicamentele care stimulează sensibilitatea mitocondrială ar putea crește producția de capcane la persoanele cu sisteme imunitare slăbite. Pe de altă parte, în afecțiuni în care capcanele contribuie la deteriorarea țesuturilor – cum ar fi în formele grave de COVID-19 sau în bolile autoimune – ar putea fi util să limităm acest răspuns.
În plus, studiul nostru ridică întrebarea dacă și alte celule imunitare folosesc mecanisme similare pentru a detecta metaboliți microbieni și dacă și alți produși bacterieni pot servi ca semnale imunitare. Înțelegerea mai detaliată a acestor căi ar putea duce la noi tratamente care să moduleze răspunsurile imunitare mai precis, reducând daunele colaterale și păstrând în același timp apărarea antimicrobiană.
Mitocondriile nu sunt doar „uzinele de energie” ale celulei – ele sunt turnurile de veghe ale sistemului imunitar, sensibile chiar și la cele mai slabe semnale metabolice ale invadatorilor bacterieni.
Pe măsură ce cercetătorii înțeleg tot mai bine rolurile lor, crește și aprecierea noastră pentru complexitatea – și adaptabilitatea – apărării celulare.
Traducere după Mitochondria can sense bacteria and trigger your immune system to trap them de Andrew Monteith, profesor de microbiologie, Universitatea Tennessee.
