
Fenomenul de capilaritate. Cu cât tubul este mai subțire, cu atât nivelul apei este mai ridicat.
Am vorbit într-un articol recent de faptul că ceara lichidă urcă spre vârful fitilului în cadrul unui proces numit capilaritate. Am explicat pe scurt ce este capilaritatea acolo, dar am simțit nevoia unei explicații mai detaliate.
Ce este capilaritatea? Este capacitatea unui corp poros sau a unui tub de a atrage un lichid, care apare în situațiile în care forțele de adeziune intermoleculară dintre lichid și solid sunt mai puternice decât forțele de coeziune intermoleculare din interiorul lichidului.
Știu, asta pare a fi o definiție de manual și chiar așa și este. Iată mai jos o explicație mai detaliată, la nivel atomic.
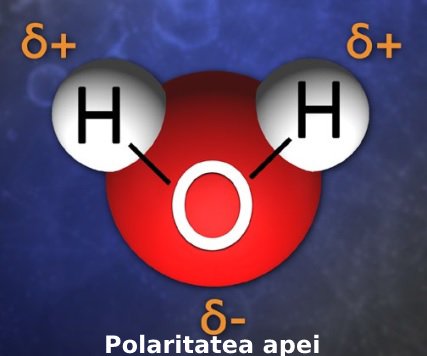
Molecula de apă este polară (există o distribuție inegală a sarcinii). Detalii poți citi în acest articol, în care explicăm, la nivel atomic, cum se dizolvă sarea în apă. În esență, este vorba despre faptul că, per ansamblu, ca urmare a electronegativității diferite a atomilor de oxigen și hidrogen care alcătuiesc molecula de apă, se ajunge ca atomul de hidrogen să aibă o sarcină parțial pozitivă, iar cel de oxigen o sarcină parțial negativă.
Electronegativitatea se referă la capacitatea nucleului atomic de a păstra electronii de pe stratul energetic cel mai îndepărtat. Oxigenul are o electronegativitate mai mare decât cel de hidrogen. Asta înseamnă că electronii puși în comun de atomii de oxigen și hidrogen sunt mai aproape de nucleul atomului de oxigen, oxigenul obținând în felul ăsta o sarcină negativă parțială (δ‾), iar hidrogenul o sarcină parțială pozitivă (δ+).
Pare că ne-am îndepărtat de subiectul articolului, dar nu este așa. Electronegativitatea și polaritatea moleculei de apă sunt importante pentru explicarea modului în care moleculele de apă „se cațără” pe pereții unui tub de sticlă ori se „strecoară” în interiorul altor materiale, „sfidând” gravitația. O să vedem imediat în ce constă această importanță.
Atunci când pui un tub cu un diametru mic într-un vas cu apă, apa va urca în interiorul acelui tub. De ce? Pentru că moleculele de apă vor fi atrase de atomii din materialul care formează vasul.
De exemplu, în cazul unui tub din sticlă, acesta este format din molecule alcătuite dintr-un atom de siliciu și atomi de oxigen. Este o diferență de electronegativitate între atomul de siliciu și cel de oxigen, în sensul că cel de oxigen are electronegativitatea mare (cum este cazul și în molecula de apă), ceea ce înseamnă, metaforic vorbind, că oxigenul „ține cu dinții” de electronii lui, pe când siliciul, cu electronegativitatea mai scăzută, renunță mai ușor la electronii de pe ultimul strat energetic.
Ce se întâmplă, pe scurt, este faptul că atomii de hidrogen din moleculele de apă se cuplează (sunt atrași) la atomii de oxigen din moleculele sticlei.
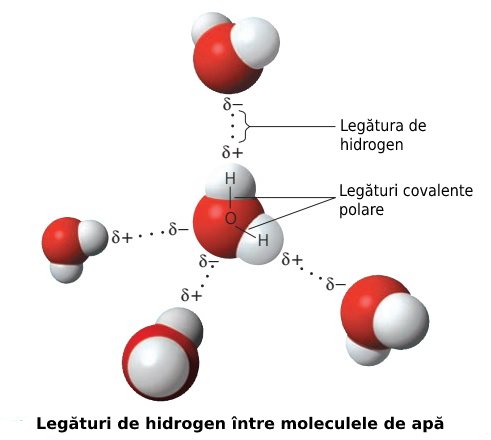
Această legătură care se formează între apă și sticlă (numită și forță de adeziune) este mai puternică decât legătura de hidrogen care există între atomii de oxigen și hidrogen ai moleculelor de apă (numită și forță de coeziune); legătura de hidrogen, cum se poate observa și în imaginea de mai sus, nu se referă la legătura covalentă dintre atomii de hidrogen și oxigen care formează o moleculă de apă, ci la legătura care se formează între atomii de hidrogen ai unei molecule de apă și atomii de oxigen ai altei molecule de apă.
Dar cum ajunge o moleculă de apă să urce, să treacă de nivelul stratului de apă? Că doar apa stă la același nivel într-un vas, nu? Secretul este următorul: prin mișcarea naturală a moleculelor de apă în cadrul lichidului, unele molecule ajung să stabilească o legătură (pe baza atracției electrice) cu o moleculă din vasul tubului care se află un pic peste nivelul apei. Pentru că apa în stare lichidă are o anumită energie, energie care, în fapt, înseamnă energia cinetică a moleculelor, mișcarea continuă a acestora, rupând legăturile de hidrogen cu unele molecule și formând altele noi cu alte molecule.
După cum ați observat în imaginea de mai sus, cu cât tubul este mai subțire, cu atât apa urcă mai sus în interiorul tubului? De ce? În ce constă această capacitate a apei de a urca mai ușor pe toată suprafața tubului (nu doar pe margini, pe pereți) atunci diametrul tubului este mai mic? Am explicat cum urcă apa pe pereți și am menționat legătura de hidrogen. Această legătură de hidrogen ține moleculele de apă unite, dar permite deplasarea masei de apă către în sus, sub acțiunea forțelor de coeziune (de atracție) care se manifestă între moleculele pereților tubului și moleculele de apă. Trebuie menționată aici și tensiunea superficială a apei, despre care am scris un articol explicativ aici.
Fenomenul capilarității îl experimentați aproape zilnic, în fapt. Nu trebuie să faceți experimente cu tuburi. Dacă puneți puțină apă pe blatul de la bucătărie și apoi puneți vârful unui șervețel de hârtie în apă, parte din apă îmbibă șervețelul. Apa o ia în sus. Sigur, ni se pare natural, pentru că este o experiență comună. Dar asta nu înseamnă că este mai puțin „miraculos”.
Nu orice lichid se comportă precum apa. Dacă puneți, de exemplu, mercur lichid în locul apei într-un vas de sticlă, veți observa că, în fapt, mercurul se depărtează de pereții vasului, pentru că legăturile de coeziune între atomii de mercur sunt mai puternice decât forțele de adeziune dintre mercur și tub.
Capilaritatea are un rol important în modul în care plantele își obțin apa și substanțele nutritive. Procesul este mai complex, dar această proprietate a apei de a urca printr-un mediu poros este esențială.
În concluzie, capilaritatea utilizează proprietățile unice ale moleculei de apă pentru a se infiltra în diverse medii, folosind, în esență, proprietatea sarcinilor electrice de semn opus de a se atrage.
Cum funcționează capilaritatea
(subtitrare în lb. engleză)
