Derivaţii halogenaţi sunt compuşii organici care conţin în molecula unul sau mai mulţi atomi de halogen. Aceştia au forma R-X (unde X poate fi F, Cl, Br sau I).
Pentru a denumi derivaţii halogenaţi, se indică poziţia în catenă sau nucleu, natura halogenului şi numele hidrocarburii. Uzual, aceşti compuşi pot fi denumiţi şi sub forma: halogenură de numele radicalului (exemplu: clorură de etil)
Exemple de derivaţi halogenaţi şi denumiri:
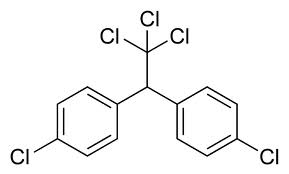 (p,p' diclorodifeniltricloroetan sau uzual - DDT)
(p,p' diclorodifeniltricloroetan sau uzual - DDT)
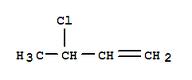 (3-cloro 1-butena)
(3-cloro 1-butena)
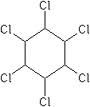 (hexaclorociclohexan)
(hexaclorociclohexan) 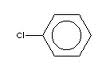 (clorobenzen)
(clorobenzen)
Clasificare:
A) după natura radicalului:
- alifactic, care poate fi atât saturat, cât şi nesaturat:
CH3-Cl ( clorometan / clorura de metil)
CH2=CH-CH2Cl (clorura de alil)
- aromatic:
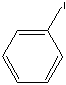 (iodobenzen)
(iodobenzen)
B) după natura halogenului, compuşii pot fi fluoruraţi, cloruraţi, bromuraţi, ioduraţi sau micşti:
CF2=CF2 (tetrafluoroetenă)
CH3-CH2-Cl (clorură de etil / cloroetan)
CH3-I (iodometan)
CH3-Br (bromometan)
CF2Cl2 (diclorodifluorometan)
C) după numărul atomilor de halogen:
- monohalogenaţi: CH3-CH2-CH2-Cl (clorură de n-propil / cloropropan)
- polihalogenaţi: C6H6Cl6 (hexaclorociclohexan)
D) după poziţia atomilor de halogen
- derivaţi halogenaţi geminali: CH3-CH2-CHCl2 (1,1-dicloropropan)
- derivaţi halogenaţi vicinali: CH2Br-CHBr-CH3 (1,2-dibromopropan)
- derivaţi halogenaţi izolaţi: CH2Cl-CH2-CH2Cl (1,3-dicloropropan)
Derivaţii halogenaţi sunt caracterizaţi de câteva proprietăţi fizice:
- Starea de agregare: compuşii pot fi solizi, lichizi sau gazoşi;
- Punctul de topire: indică temperatura necesară pentru a schimba starea de agregare de la solid la lichid;
- Punctul de fierbere: indică temperatura necesară pentru a schimba starea de agregare de la lichid la gazos.
Starea de agregare, precum şi punctele de topire şi fierbere diferă de la compus la compus!
- Solubilitatea: deoarece au în structura lor legături covalente polare carbon - halogen,compuşii halogenaţi sunt solubili în solvenţi polari (etanol, acetonă etc), dar aproape insolubili în solvenţi nepolari şi în apă (în general, o substanţă este solubilă în apă, dacă poate forma cu moleculele acesteia legături de hidrogen).
Reactivitatea derivaţilor halogenaţi depinde de:
I) Natura atomului de halogen (R-F < R-Cl < R-Br < R-I);
II) Natura radicalului hidrocarbonat:
- reactivitate normală : derivaţi de la alcani şi cicloalcani;
- reactivitate mărită : compuşi ce au halogen în poziţia alilică sau benzenică;
- reactivitate redusă : compuşi ce au halogenul legat de atomul de carbon al legăturii duble (vinilic) sau de nucleul benzenic (aromatic).
Bibliografie: manualele alternative de chimie de clasa a XI-a.
