 Putem bloca evoluţia tumorilor generate la nivelul ţesuturilor inflamate cronic cu ajutorul agenţilor anti-inflamatori cunoscuţi, fără riscul apariție efectelor secundare? Cum ar fi dacă administrarea aspirinei ar putea reduce riscul apariție cancerului?
Putem bloca evoluţia tumorilor generate la nivelul ţesuturilor inflamate cronic cu ajutorul agenţilor anti-inflamatori cunoscuţi, fără riscul apariție efectelor secundare? Cum ar fi dacă administrarea aspirinei ar putea reduce riscul apariție cancerului?
Cercetătorii au dezbătut timp de mai mulţi ani relaţia dintre inflamaţie şi cancer, dar studii recente au reaprins discuţia legată de faptul că există dovezi conform cărora administrarea aspirinei zilnic timp de 5 ani sau mai mult poate preveni decesul cauzat de cancerul colorectal şi alte neoplasme solide.
Dacă această observaţie este într-adevăr adevărată şi aspirina poate opri evoluţia cancerului sau să reducă riscul de recidivă, acest medicament vechi, bine cunoscut, ar putea oferi un tratament frustrant de simplu.
Din păcate, administrarea aspirinei şi a altor antiinflamatoare nesteroidiene (AINS) nu este lipsită de efecte secundare care ridică probleme, sporind riscul de toxicitate hepatică şi hemoragie digestivă sau cerebrală atunci când sunt administrate pe perioade lungi. Cercetătorii care au studiat căile moleculare aflate la intersecţia dintre cancer şi inflamaţie speră că vor putea descoperi modalităţi mai selective de a reduce inflamaţia, prin combaterea şi reducerea efectelor secundare ale aspirinei fără a sacrifica beneficiile acesteia.
Când Peter Rothwell de la Spitalul John Radcliffe din Headington, Oxfordshire şi colegii săi au analizat datele individuale ale pacienţilor din cadrul a opt studii randomizate în care pacienţii au luat o aspirină pe zi pentru prevenirea bolilor cardiovasculare, ei au observat că în rândul celor care au luat aspirină zilnic incidenţa decesului cauzat de cancer a fost mai mică decât în cazul celor care nu au luat aspirină. Studiile anterioare au arătat că utilizarea zilnică a aspirinei şi a altor AINS pe perioade lungi a redus riscul apariţiei cancerului colorectal sau recidiva polipilor colonici, dar nu există dovezi certe disponibile până în prezent, cel puţin nu la oameni, că aspirina ar putea de asemenea, reduce riscul apariţiei altor tipuri de cancer.
În cadrul noului studiu, beneficiile utilizării aspirinei au fost evidente după cel puţin cinci ani de tratament. În studiile în care pacienţii au luat aspirină timp de peste 7,5 ani, riscul de deces prin cancer după 20 de ani (de la iniţierea studiului) a fost redus cu aproximativ 30% în cazul tuturor tipurilor de cancer solide şi cu 60% în cazul cancerului gastro-intestinal. În cazul cancerului pulmonar şi esofagian, beneficiul a fost limitat la subtipurile de cancer provenite de la nivelul ţesutului glandular (adenocarcinoame). În ceea ce priveşte cancerul colorectal, efectul a fost ridicat în cazul cancerului colonului proximal, dar nu şi în cel al colonului distal.
Aceste date sugerează în mod cert importanţa medicamentelor anti-inflamatorii în prevenirea iniţierii şi progresiei atât a cancerului gastro-intestinal, cât şi a celui localizat la nivelul altor organe solide (inclusiv cel pulmonar şi de prostată) şi sugerează că inflamaţia poate fi o cauză principala a cancerului, chiar şi în cazul tipurilor de tumori despre care nu s-a considerat în mod tradiţional că s-ar dezvolta de la nivelul ţesuturilor inflamate cronic.
Genele inflamaţiei şi ale cancerului
Deşi rolul inflamaţiei în stimularea carcinogenezei a generat mult interes în ultimii 10-15 ani, medicul grec Claudius Galenus a observat unele similitudini între cancer şi inflamaţie cu aproape două mii de ani în urmă. Galenus a folosit iniţial termenul aparținând lui Hipocrate de "cancer", în special pentru a descrie anumite tumori inflamatorii ale sânului în care venele superficiale păreau umflate şi radiante, oarecum asemenea ghearelor unui crab. Mai târziu, numele a fost extins pentru a include toate tumorile maligne şi infiltrante. În 1863, Rudolf Virchow a remarcat prezenţa globulelor albe (leucocitelor) la nivelul ţesuturilor neoplazice şi a realizat o conexiune între inflamaţie şi cancer. El a sugerat că prezenţa "infiltratului limforeticular" reflectă faptul că originea cancerului se află la nivelul zonelor de inflamaţie cronică. O observaţie decisivă a fost făcută cu mai bine de un secol mai târziu, atunci când Harold Dvorak de la Universitatea Harvard, a remarcat că inflamaţia şi cancerul posedă unele mecanisme fundamentale de dezvoltare (angiogeneză) şi celule care infiltrează ţesutul (limfocite, macrofage şi mastocite) şi că tumorile acţionează "ca şi răni care nu se vindecă."
Cercetătorii speră să găsească modalităţi mai selective de a combate sau minimaliza efectele adverse negative ale aspirinei fără să îi sacrifice beneficiile.
Inflamaţia cronică poate afecta toate fazele carcinogenezei prin favorizarea apariţiei mutaţiilor genetice iniţiale care conduc la formarea cancerului. Aceasta poate acţiona pe post de iniţiator al tumorii ducând la apariţia unor circumstanţe la nivelul ţesuturile înconjurătoare care permit tumorii să progreseze şi să metastazeze şi chiar să declanşeze mecanisme imunosupresoare care să prevină declanşarea unui răspuns imun împotriva tumorii.
În 2004, Robert Bass Jr. de la University of Texas M. D. Anderson Cancer Center şi colegii săi au demonstrat pentru prima dată că gena cancerigenă RAS, de asemenea, joacă un rol important în inflamaţie. Studii recente au promovat acest studiu, dezvăluind faptul că astfel de gene au adesea roluri duble. Mai multe gene cunoscute pentru rolul pe care îl joacă în cancer atunci când sunt anormal activate, oncogenele RAS, RET, BRAF, SRC şi MYC par, de asemenea, să joace un rol în inflamaţie. Aceste gene declanşează calea inflamatorie în cadrul celulei şi activează inflamaţia în exteriorul celulei prin recrutarea şi iniţierea celulelor inflamatorii care creează un mediu ce duce la scăderea posibilităţii de apărare a celulelor sistemului imunitar împotriva cancerului. În mod interesant, datorită modificărilor epigenetice, activarea continuă şi supraexpresia oncogenelor s-ar putea să nu fie întotdeauna necesare pentru menţinerea acestui ciclu inflamator. Activarea tranzitorie a oncoproteinei SRC induce o modificare epigenetică care utilizează reglarea microRNA pentru a menţine constantă producerea de IL-6, o citokină proinflamatorie importantă. Alterarea severă a ADN, cum ar fi apariţia unor pauze duble irecuperabile, activează enzima mutantă a ataxiei telangiectasia (gena ATM), o kinază care repară ADN-ul, dar secretă în acelaşi timp factori pro-inflamatori. Exact aceşti factori vor crea condiţii care stimulează proliferarea oncogenică de celule cu pauze duble, menţinând astfel producerea de factori proinflamatori, printr-un ciclu de feedback pozitiv.
În ultimii ani, cercetătorii au început să aprecieze rolul jucat de mediul tumoral în creşterea şi supravieţuirea acesteia. Într-adevăr, inflamaţia ţesutului din jurul unei tumori poate grăbi procesul de oncogeneneză, prin promovarea în mod direct a instabilităţii genetice şi prin favorizarea sau inducerea apariţiei unor mutaţii genetice. Specii reactive de oxigen şi azot (ROS şi RNS), care sunt abundente în timpul inflamaţiei, pot induce mutaţii ale ADN-ului, modificări epigenetice şi modificări posttranslaţionale ale proteinelor care controlează ciclul celular sau de supravieţuire. A fost demonstrat faptul că în special ROS şi RNS reduc expresia şi activitatea enzimatică a proteinelor care repară ADN-ul defectuos (PRD), printre care se numără şi proteina mutL 1 (MLH1) şi proteinele mutS 2 şi 6 (MSH2 şi MSH6), ducând la apariţia unei instabilităţi genetice crescute. Cercetătorii au remarcat de asemenea că activarea unei proteine numită citidin deaminază (AID) care produce mutaţii la nivelul ADN-ului activ în timpul maturării limfocitelor B a fost anormal de intensă la nivelul celulelor epiteliale inflamate, un efect direct corelat cu apariţia cancerului colorectal. Aceste mecanisme sugerează implicarea instabilităţii genomice, a modificărilor epigenetice şi a modificările funcţionale ale proteinelor în etapele incipiente ale cancerului indus de inflamaţie.
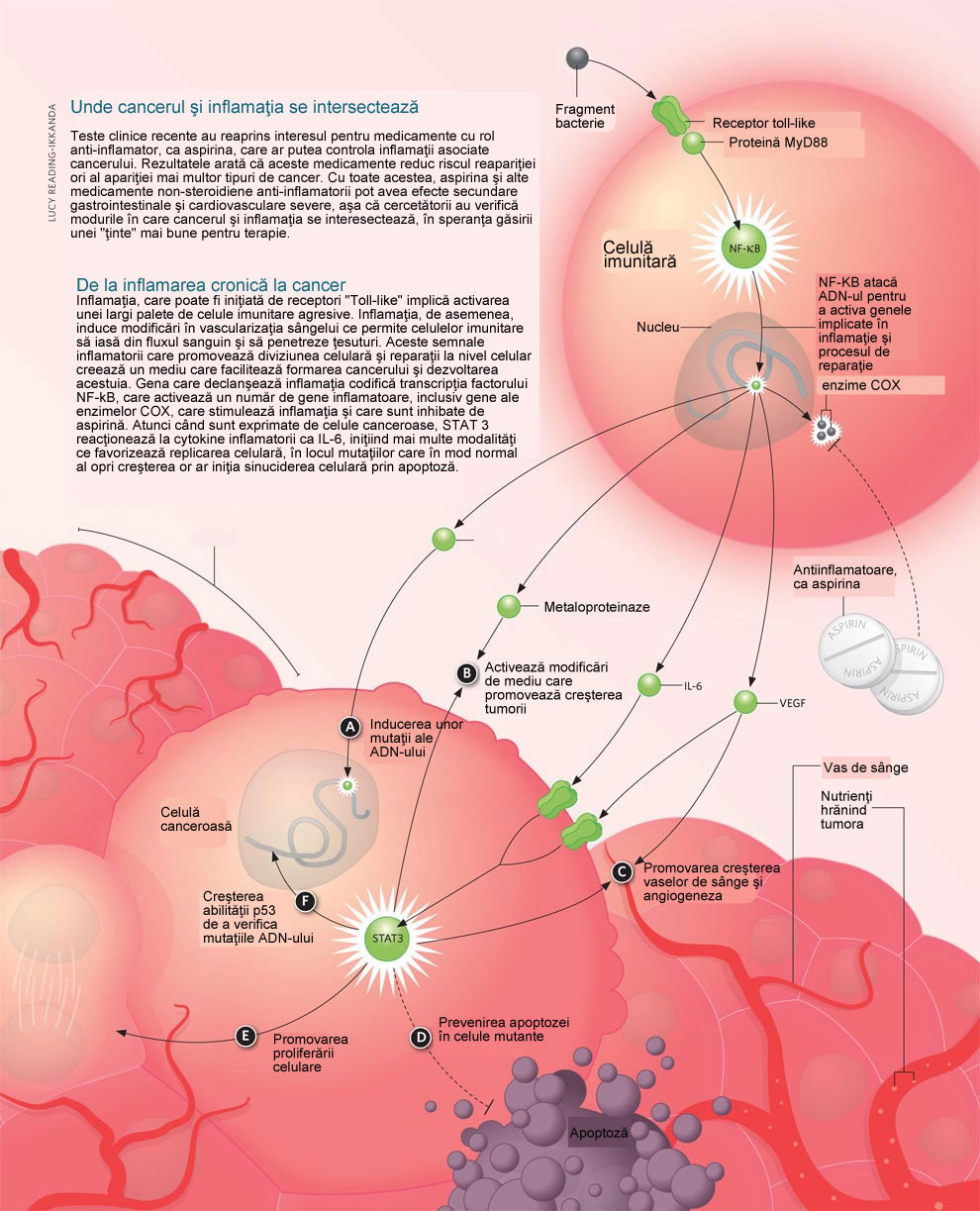
Încrucişarea căilor inflamatorii cu cele cancerigene
Un număr de receptori imuni înnăscuţi, aşa cum sunt numeroşi membri ai familiei receptorilor Toll like (RTL) şi alţi receptori de recunoaştere de patternuri (RSRP), activează semnalele inflamatorii în celulă atunci când se confruntă cu existenţa unor semne ale unei infecţii bacteriene sau virale, cum ar fi prezenţa acizilor nucleici şi a unor părţi aparţinând peretelui celular bacterian sau flagelului. Dovezi recente au dezvăluit că activarea căilor prin intermediul acestor receptori imuni înnăscuţi activează de asemenea proliferarea, diferenţierea celulelor şi moartea celulară care pot determina o celulă să se transforme într-o celulă canceroasă.
Aceşti receptori activează primul mecanism de răspuns al celulei care declanşează factori de transcriere majori care la rândul lor activează rapid gene cu scopul de a pregăti celulele pentru atacul agresiunii. Factorii de transcripţie, NF-κB, STAT3 şi proteinele adaptor MyD88 se dovedesc, de asemenea, a fi esenţiali în anumite tipuri de cancer, fiecare dintre ei reprezentând cheia iniţierii răspunsului inflamator înnăscut.
NF-κB a fost descoperită pentru prima dată de David Baltimore în 1986 ca fiind o proteină implicată în imunitate şi ulterior s-a demonstrat că aceasta declanşează inflamaţia înnăscută. În prezent, cercetările încep să indice faptul că expresia sa este, de asemenea, necesară pentru oncogeneza multor ţesuturi. NF-κB activează genele implicate în reglarea ciclului celular, angiogeneză şi supravieţuirea celulară, precum şi genele care codifică citokine pro-inflamatorii, chemokine şi proteaze, procese care pot juca un rol major în iniţierea şi progresia cancerului atunci când nu sunt ţinute sub control în mod corespunzător.
STAT3 este un alt factor de transcripţie important implicat în imunitate şi inflamaţie. Acesta este, de asemenea, suprareglat şi fosforilat în cele mai multe tipuri de cancer. STAT3 contribuie la supravieţuirea, proliferarea şi difuzarea celulelor tumorale prin controlul expresiei mai multor gene ale ciclului celular şi a proto-oncogenei c-myc. STAT3 favorizează, de asemenea, supravieţuirea celulelor maligne prin prevenirea apoptozei în parte prin subreglarea p53 şi prin controlul factorilor pro-angiogenici şi metastatici cum ar fi FCEV (factorul de creştere al endoteliului vascular) şi metaloproteinazele.
Noi constatări ridică multiple întrebări cu privire la cea mai importantă cale de semnalizare celulară
În cancerele cutanate, expresia STAT3 la nivelul celulelor epiteliale este necesară pentru iniţierea genezei cancerului sugerând că inflamaţia este o componentă necesară a carcinogenezei în acest ţesut. În mod paradoxal, când este declanşată în celulele canceroase, expresia STAT3 activează chemokine care promovează inflamaţia şi imunitatea. Cu toate acestea, atunci când este activată în celulele sistemului imunitar, aceeaşi cale iniţiază semnale anti-inflamatorii sau imunosupresoare care protejează tumora de atacul imun. Aceste activităţi contrastante ale STAT3 favorizează creşterea tumorală deoarece celulele imunitare activate care sunt recrutate de la nivelul inflamaţiei furnizează factori de angiogeneză şi de refacere a matricei extracelulare, ambele favorizând creşterea tumorii în timp ce răspunsurile inflamatorii şi imune marcate care sunt asociate cu efecte antitumorale şi anti-angiogene sunt împiedicate.
Atât activitatea NF-κB (factor nuclear kappa al celulelor B), cât şi cea a STAT3 sunt activate şi reglate de o serie de mecanisme şi de molecule de reglare. Unul dintre aceste mecanisme este controlat de proteinele receptor de semnalizare MyD88 necesare pentru semnalizarea în aval a majorităţii receptorilor Toll-like (RTL) şi a familiei de citokine pro-inflamatorii a interleukinei-1 (IL-1). MyD88 este deosebit de importantă pentru activarea NF-κB şi pentru unele dintre cele mai importante căi moleculare ale inflamaţiei înnăscute.
Recent, s-a constatat faptul că MyD88 are un rol important în avansarea tumorii. Şoarecii cu o întrerupere la nivelul genei MyD88 au prezentat mai puţine cazuri a anumitor tipuri de cancer, cum ar fi cancerul cutanat şi cel hepatic, precum şi sarcoame induse prin tratamente chimice. În plus, la şoarecii care prezintă deficit de MyD88 supuşi mai multor agenţi iniţiatori de cancer a fost observată o reducere a ratei de creştere tumorală. În multe dintre aceste modele experimentale, rolul protumoral al semnalizării MyD88 a fost atribuit parţial inducţiei receptorilor RTL sau ai IL - 1 prin semnalizarea STAT3 în aval.
Aceste date experimentale obţinute pe animale au fost recent validate în cadrul unor studii efectuate pe oameni. Pentru a putea continua să se dezvolte la om, un subtip de limfom cu celule B este dependent de prezenţa unei mutaţii la nivelul genei MyD88 care duce la apariţia unei molecule hiperactive. Supraexpresia genei MyD88 în acest tip de cancer promovează supravieţuirea celulelor prin asamblarea în mod spontan a unui complex MyD88, ducând la creşterea semnalizării NF-κB, activării STAT3 şi secreţiei altor citokine inflamatorii. Aceste constatări sprijină pe deplin conceptul conform căruia semnalizarea receptorilor înnăscuţi în celulele tumorale reglează atât inflamaţia intrinsecă cât şi fenotipul celulelor canceroase. O excepţie interesantă este faptul că MyD88 oferă protecţie împotriva cancerului de colon în modele experimentale în care distrugerea mucoasei este indusă chimic ducând la alterarea semnificativă a expunerii sistemului imunitar la bacterii intestinale. Aceste constatări sprijină în continuare rolul important al receptorilor înnăscuţi în interacţiunile celulă-celulă, precum şi în controlul homeostatic al relaţiei de simbioză cu flora saprofită având efecte aparent paradoxale privitoare la iniţierea şi progresia tumorii.
Studiile experimentale şi datele clinice cu privire la rolul MyD88 în cancer furnizează dovezi puternice că inflamaţia înnăscută şi receptorii imuni înnăscuţi joacă un rol în carcinogeneză. Cu toate acestea, aceste constatări ridică de asemenea mai multe întrebări noi legate de depistarea celor mai importante căi de semnalizare ale celulelor, a celulelor care sunt implicate în producţia de liganzi pentru receptorii cuplaţi cu MyD88. De asemenea, ne propunem să aflăm dacă RTL sau familia de receptori ai IL-1 joacă rolul predominant. O altă întrebare cheie este dacă semnalizarea MyD88 stimulează carcinogeneza prin inducerea unui răspuns inflamator sau dacă aceasta afectează în mod direct supravieţuirea şi proliferarea celulelor tumorale.
Putem să prevenim cancerul prin acţionarea asupra inflamaţiei?
În timp ce aceste căi moleculare care se interferează furnizează dovezi experimentale care sprijină rolul răspunsurilor înnăscute inflamatorii în carcinogeneză, cele mai puternice dovezi clinice la om sunt obţinute prin demonstrarea prezenţei unei asocieri dintre infecţiile cronice şi cancer precum şi prin constatarea faptului că administrarea regulată a aspirinei sau a altor AINS scade incidenţa cancerului.
AINS acţionează prin inhibarea cyclooxigenazelor (COXs), COX-1 şi COX-2, care sunt responsabile pentru producerea de prostaglandine din acizi graşi. Aceste enzime catalizează sinteza de prostaglandine E2 care promovează inflamaţia prin dilatarea vaselor de sânge permiţând celulelor imune să treacă din sânge în ţesuturi. Această moleculă de semnalizare reglează, de asemenea, angiogeneza şi stimulează reîntoarcerea celulelor hematopoietice, îndrumând celule progenitoare spre ţesutul afectat şi stimulându-le să se diferenţieze în mai multe tipuri de celule imunitare necesare pentru refacere. Elementele constitutive exprimate ale COX-1 contribuie la homeostazia mucoasei gastro-intestinale, în timp ce inducerea COX-2 este reglată de diverse citokine pro-inflamatorii. AINS, cum ar fi aspirina inhibă atât COX-1 cât şi COX-2, explicând toxicitatea considerabilă şi afectarea de la nivelul stomacului şi a mucoasei intestinale, care poate apărea în urma administrării acestor medicamente. Inhibitorii selectivi ai COX-2, cum ar fi Vioxx, inhibă numai enzima inductibilă COX-2 care este activată în timpul inflamaţiei păstrând intactă homeostazia gastro-intestinală. Cu toate acestea, multe dintre aceste medicamente au fost retrase de pe piaţă datorită toxicităţii cardiovasculare anunţate cauzate de derivarea substratului COX-2 şi anume a acidului arahidonic, pe calea 5-lipooxigenazei generând astfel leucotriene mai degrabă decât prostaglandine.
Deşi s-a crezut iniţial că sunt suprareglate în cancerul colorectal, COX-2 s-au dovedit a fi extrem de exprimate în aproape orice tip de tumori în etapele iniţiale ale formării acestora. Într-adevăr, inhibitorii COX-2 specifici au crescut atât supravieţuirea globală şi cea după recurenţă post rezecţie chirurgicală, dar numai la subgrupul de pacienţi cu cancer colorectal la care COX-2 era supraexprimată sau care au posedat forme mutante ale genei. Interesant este faptul că inhibitorii COX-2 nu doar au prevenit apariţia cancerului, ci au condus, de asemenea, la o scădere a numărul de polipi deja formaţi la pacienţii cu polipoză adenomatoasă familială, o afecţiune ereditară caracterizată prin debutul precoce al cancerului de colon.
Deşi aceste rezultate sunt încurajatoare, atât inhibitorii COX nespecifici cum ar fi aspirina, cât şi inhibitorii COX-2 specifici prezintă o toxicitate semnificativă care trebuie să fie pusă în balanţă cu beneficiile lor demonstrate. Un aspect interesant abordat de Rothwell şi colegii săi în cadrul meta-analizei este acela că efectul preventiv al tratamentului zilnic pe termen lung cu AINS asupra cancerului nu se limitează doar la prevenirea cancerului de colon în rândul persoanele cu risc ridicat datorat polipilor recurenţi sau a predispoziţiei genetice. Administrarea AINS este, de asemenea, eficientă în prevenirea cancerului de colon sporadic şi a multor altor tumori gastro-intestinale şi nongastrointestinale solide inclusiv a celei de esofag, pancreas, stomac, plămâni, creier şi prostată. Deşi analiza publicată a inclus un număr foarte mare de persoane, studiul a avut unele rezerve. De exemplu, iniţial obiectivul final al studiului clinic nu a fost cancerul, informaţiile disponibile în diferitele studii nu au avut întotdeauna acelaşi nivel de precizie, iar datele referitoare la cancerele nongastrointestinale (exceptând cancerul pulmonar), nu au avut semnificaţie statistică completă în ciuda numărului mare de pacienţi analizaţi. Cu toate acestea, aceste date subliniază în mod cert necesitatea continuării evaluărilor pentru a determina dacă acţionarea asupra căilor inflamatorii poate duce la prevenirea cancerului.
Deşi inhibitorii COX au în mod cert o activitate anti-inflamatorie evidentă, rolul lor de prevenţie a cancerului poate fi datorat şi altor efecte ale acestor medicamente sau unor efecte noninflamatorii înrudite legate de acţiunea prostaglandinelor asupra vasodilataţiei, angiogenezei, ratei de mutaţie a ADN, aderării celulelor epiteliale sau apoptozei. Cu toate acestea, rezultatele clinice impresionante alături de dovezi clinice şi experimentale extinse furnizate de echipa lui Rothwell oferă dovezi ale existenţei unei legături cauzale între inflamaţie şi cancer şi indică posibilitatea ca studierea bine ţintită a căilor inflamatorii înnăscute ar putea duce la prevenirea cancerului, într-un mod chiar mai eficient şi cu mai puţine efecte secundare toxice.
Este important să ne amintim totuşi faptul că inflamaţia înnăscută joacă un rol extrem de semnificativ în homeostazia ţesutului normal, rezistenţa la infecţii şi în răspunsul la leziuni tisulare şi că aceleaşi căi inflamatorii care sunt interceptate de tumori pentru a grăbi propria lor progresie joacă de asemenea un rol fiziologic important în domeniul sănătăţii. Obţinerea unui efect de prevenţie împotriva tumorii prin orientarea acestor căi moleculare fără a afecta negativ celelalte roluri fiziologice ale acestor molecule poate fi o sarcină dificilă, una care va necesita înţelegerea mai profundă a tuturor mecanismelor moleculare inflamatorii implicate în fiziologie, apărarea gazdei şi carcinogeneză.
Totuşi, trăim vremuri interesante. Atât dovezile clinice, cât şi cercetările preclinice indică posibilitatea concretă de a avea succes în prevenirea cancerului dacă avem ca obiectiv inflamaţia şi dacă depunem un efort în acest sens. Această perspectivă ar trebui să încurajeze acordarea unui sprijin important pentru continuarea eforturilor ştiinţifice în acest domeniu care a dovedit un potenţial medical incontestabil.
Traducere după An-aspirin-for-your-cancer.
Translated with permission of The Scientist magazine which is not responsible for any errors occurring as a result of translation.
Traducerea: Ecaterina Pavel
