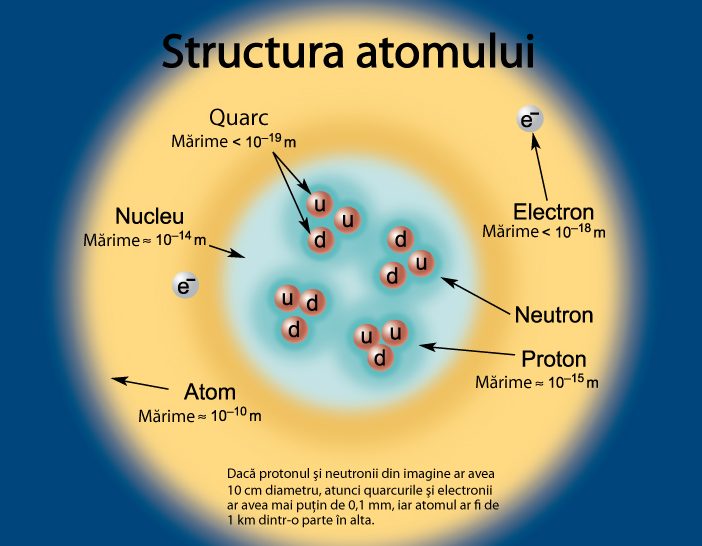
Atomii sunt formați din electroni, particule elementare organizate în straturi electronice la exteriorul atomului, și nucleu. Nucleul aste format din protoni și neutroni, care nu sunt însă particule elementare, ci, la rândul lor, sunt formate din alte particule, de care știm că ar fi elementare (nu sunt alcătuite din ale particule) denumite quarcuri.
Numărul de protoni dă identitatea atomului, adică ne spune dacă este vorba, de exemplu, de un atom de hidrogen (care are un proton) sau de unul de carbon, care are șase protoni. Numărul de protoni se numește „numărul atomic” - puteți citi un articol despre numărul atomic aici.
Numărul de neutroni, care sunt particule neutre din punct de vedere electric (nu au sarcină electrică), afectează masa atomului, dar nu și proprietățile chimice ale acestuia. Proprietățile chimice sunt determinate de numărul atomic. Prin urmare, carbonul-12, care are 6 protoni și 6 neutroni, va avea aceleași proprietăți chimice precum atomul-14, cu 6 protoni și 8 neutroni, dar nu aceeași masă.
Masa atomilor se măsoară în funcție de „unitatea atomică de masă”. Unitatea atomică de masă este, așadar, o unitatea de măsură utilizată în exprimarea maselor atomilor, moleculelor și particulelor subatomice. Este definită ca fiind 1/12 din masa izotopului carbon-12 ori 1,6605402 x 10−24 grame.
Dar cum masa unui atom este formată din masa particulelor ce formează nucleul, plus masa electronilor, este clar că masa unui atom nu este similară cu masa protonilor și neutronilor, deși electronii au masa mult mai mică. În fapt, masa unui electron este de 1.840 de ori mai mică decât masa unui proton / neutron.
Citește și:
→ Dacă am pune unul lângă altul toţi atomii din univers, cât spaţiu ar ocupa?
→Vezi și posterul scientia: Particulele elementare (unde detaliem structura atomului)
