
Mendeleev a construit tabelul ce-i poartă numele în mod empiric, fără a cunoaşte structura atomului. Intuiţia sa extraordinară a făcut ca cercetătorii să bănuiască existenţa unor elemente doar privind la tabel, din logica acestuia. Astăzi ştim că tabelul oferă o imagine a modului în care se completează nivelurile energetice ale atomilor.
TABELUL LUI MENDELEEV

Portret al lui Mendeleev realizat de Ilia Repin
Credit: wikimedia.org
Tabelul periodic al elementelor reprezintă - după cum cei mai mulţi cititori ştiu - o listă a tuturor tipurilor de atomi ce constituie Universul. Identitatea unui atom - adică ceea ce face ca un atom să fie, de pildă, de H - este dată de numărul de protoni din nucleul atomic. Numărul de protoni ai unui atom este egal cu numărul de electroni, ceea ce face ca atomul să fie neutru din punct de vedere electric. Numărul neutronilor poate diferi pentru atomi ai aceluiaşi element, situaţie în care atomul se numeşte izotop. Tabelul periodic aşază elementele în funcţie de numărul de electroni ai atomilor. Hidrogenul are un electron şi se află la începutul tabelului, heliul are 2, carbonul 6, oxigenul 8, aurul 79, uraniul 92 etc.
Se cunoaşte astăzi că aranjamentul electronilor în cadrul atomilor determină proprietăţile chimice ale acestora, iar aranjamente similare dau naştere unor proprietăţi asemănătoare.
Deşi fiecare electron dintr-un atom e caracterizat de 4 numere cuantice care îl descriu în mod unic, doar două dintre acestea intervin în discuţia despre tabelul periodic. Numărul cuantic „n” determină energia electronului în fiecare orbital (cu câteva ajustări date de celelalte numere), iar numărul cuantic „l” determină forma orbitalului.
Toate elementele din tabelul periodic sunt aranjate în grupuri pe baza valorii lui „l”.
Elementele din aceeaşi coloană au electronii exteriori dispuşi pe orbitali de forme identice, ceea ce înseamnă că au proprietăţi chimice similare (vezi figura de mai jos).
Tabelul periodic al elementelor este format din patru blocuri, individualizate grafic prin culori distincte, aşa cum se poate observa în figura de mai jos, unde blocul s este albastru, p este galben, d este roz, iar f este verde. Blocul s are l=0 şi fiecare linie din acest grup poate găzdui 2 elemente.
Blocul p are l=1 şi fiecare linie din acest bloc poate găzdui 6 elemente.
Blocul cu l=2 - blocul d - poate ţine 10 elemente pe linie, iar blocul corespunzător lui l=3, blocul f, poate găzdui 14 elemente pe linie.
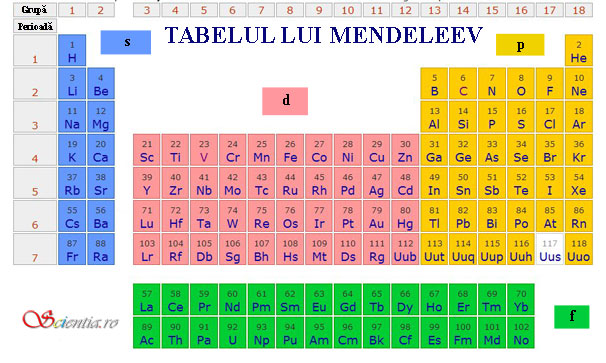
Blocurile s, p, d şi f
Forma corectă a tabelului lui Mendeleev
Într-un anume bloc, n creşte cu unu pentru fiecare linie din tabel. Deci electronii exteriori ai elementelor situate dedesubtul altor elemente au mai multă energie şi sunt mai slab legaţi de atomi. Pe măsură ce se adaugă electroni în jurul atomilor, fiecare nou electron ocupă cel mai scăzut nivel energetic disponibil, iar nivelurile energetice ale orbitalilor determină unde diferitele blocuri „l” (s, p, d, f) îşi au loc în tabel, pe verticală.
CONFIGURAŢIA ELECTRONICĂ A ATOMILOR. CELE 4 NUMERE CUANTICE
Electronii sunt distribuiţi în cadrul atomilor pe straturi, substraturi şi orbitali. Numărul cuantic „n” identifică stratul, deci nivelul energetic al unui anume electron în cadrul configuraţiei electronice a atomului respectiv. Numărul cuantic „l” determină substratul (s, p, d sau f) pe care electronul se găseşte. Numărul cuantic „ml” desemnează orbitalul în cadrul căruia un electron poate fi localizat.
În cadrul oricărui strat, primul substrat este desemnat ca fiind „s” şi consistă dintr-un singur orbital, al doilea substrat se numeşte „p” şi consistă din 3 orbitali (nu neapărat toţi fiind „populaţi” cu electroni), al treilea substrat este numit întotdeauna „d” şi consistă din 5 orbitali, al patrulea substrat se numeşte „f” şi consistă din 7 orbitali, iar lista poate continua (cu denumirea substraturilor în ordine alfabetică: g, h, i etc.).
Tipul unui orbital (deci substratul căruia îi aparţine) este strâns legat de forma orbitalului. De pildă, orbitalii din substraturile „s” („orbitalii s”) sunt sferici şi simetrici, iar „orbitalii p” pot fi descrişi ca având doi lobi etc. O altă metodă de a desemna un substrat, deci tipul unui orbital, este prin intermediul numărului cuantic orbital „l”. Valorile sunt : 0 pentru „orbitalii s”, 1 pentru „orbitalii p”, 2 pentru „orbitalii d”, 3 pentru „orbitalii f”, 4 pentru „orbitalii g”, etc.
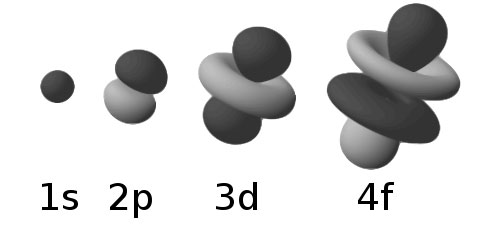
Formele geometrice asociate orbitalilor de pe diferitele substraturi
Ca regulă, pentru o anumită valoare a lui n avem n substraturi şi n2 orbitali. Mai mult, un strat poate „găzdui" 2n2 electroni, iar un substrat poate fi ocupat de maxim 2(2l+1) electroni.
Al treilea număr cuantic este ml, numărul cuantic magnetic, care identifică orbitalii în cadrul substraturilor, iar fiecare valoare a lui ml corespunde uneia din orientările permise pentru câmpul magnetic asociat orbitalului (pentru un substrat „p" - ml poate fi -1,0 sau 1, pentru un substrat „d", ml poate fi -2,-1,0,1 sau 2 etc.).
Al patrulea număr cuantic este ms - spinul electronului, care poate avea doar două valori: +1/2 (spin paralel) şi -1/2 (spin opus). Pe un orbital încap maxim 2 electroni, primul ocupant fiind de spin paralel, iar al doilea, în mod obligatoriu, de spin opus.
Cvadrupletul (n, l, ml, ms) descrie complet un electron din configuraţia unui atom, iar principiul excluziunii formulat de Pauli spune că nu pot exista doi electroni într-un atom care să aibă valori identice pentru toate cele 4 numere cuantice.
→ Vezi AICI posterului nostru: Tabelul periodic al elementelor
Bibliografie:
www.cassiopeiaproject.com
en.wikipedia.org/wiki/Electron_configuration
knol.google.com/k/glenn-lo/atomic-orbitals/28prei6i5vxn0/29#
www.lefo.ro/chimie/comSYS/Configuratia%20electronica/teorie/text.html
