 Modelul cuantic al atomului reprezintă o schimbare fundamentală sub aspect grafic al modelului atomic în comparaţie cu atomul lui Bohr. Fizicieni ca Heinsenberg, Schrödinger ori Dirac au eliminat orbitele clasice ale electronilor şi le-au înlocuit cu orbitali, volume spaţiale caracterizate de probabilitatea prezenţei electronilor.
Modelul cuantic al atomului reprezintă o schimbare fundamentală sub aspect grafic al modelului atomic în comparaţie cu atomul lui Bohr. Fizicieni ca Heinsenberg, Schrödinger ori Dirac au eliminat orbitele clasice ale electronilor şi le-au înlocuit cu orbitali, volume spaţiale caracterizate de probabilitatea prezenţei electronilor.
MODELUL CUANTIC AL ATOMULUI - PE SCURT
Principalele caracteristici ale modelului cuantic al atomului sunt următoarele:
• starea atomului este descrisă de funcţii matematice;
• atomul este constituit din nucleu (quarcuri care formează protoni şi neutroni) şi electroni distribuiţi în jurul nucleului;
• electronii nu se mişcă pe orbite fixe în jurul nucleului, ci ocupă orbitali cu diferite forme, funcţie de tipul de atom;
orbitalul reprezintă volumul din spaţiul din jurul nucleului caracterizat de o mare probabilitate de a găsi electroni;
• nivelurile de energie sunt compuse din mai multe substraturi energetice;
• nici un orbital nu conţine electroni identici (cu aceleaşi numere cuantice)
(restricţia este impusă de principiul de excluziune al lui Wolfgang Pauli).
Modelul atomic al lui Niels Bohr (1885-1962) funcţionează foarte bine pentru atomul de hidrogen şi explică spectrul atomic, dar nu este adecvat atomilor cu un număr mai mare de electroni. Un număr de întrebări ca de exemplu: de ce electronii sunt ţintuiţi pe anumite niveluri energetice, de ce prima orbită poate ţine doar 2 electroni, iar celelalte orbite câte 8 etc., nu pot fi lămurite de către teoria ce susţine modelul atomic al Bohr.
Pentru a înţelege istoria evoluţiei ideii atomului, citiţi şi:
Modelul atomic al lui John Dalton (1803)
Modelul atomic al lui J.J.Thomson (1904)
Modelul atomic al lui Ernest Rutherford (1909)
Modelul atomic al lui Niels Bohr (1913)
LOUIS DE BROGLIE ŞI DUALITATEA UNDĂ-PARTICULĂ A MATERIEI
Louis de Broglie (1892-1987), studiind ideea că lumina are o dublă natură - undă şi particulă - a avansat ipoteza că poate şi materia, considerată a fi constituită din particule prin excelenţă, are o dublă natură. Electronii erau consideraţi particule şi atât, având masă, viteză şi celelalte caracteristici ale unei particule. De Broglie şi-a expus ipoteza într-o formulă foarte simplă:
unde λ este lungimea de undă, h este constanta lui Planck cu valoarea 6,63x10-34 Js, m este masa, iar v este viteza.
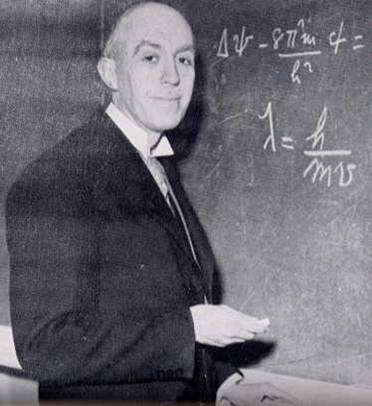
Credit: www710.univ-lyon1.fr
Prin această ecuaţie sunt surprinse ambele naturi ale materiei, undă şi particulă, partea stângă fiind pentru undă, iar partea dreaptă fiind pentru particulă. Se poate observa un lucru privind ecuaţia: cu cât este mai mică masa unui lucru, cu celelalte variabile neschimbate, cu atât lungimea de undă va fi mai mare.
După această formulă vă puteţi calcula lungimea de undă a corpului dumneavoastră, numai că rezultatul va fi incomprehensibil de mic. Dar aplicată în domeniul subatomic, ecuaţia va da o soluţie de altă natură, în sensul că poate fi verificată experimental, căci pentru electron de pildă, care are o masă foarte mică, lungimea de undă este 1,21x10-16 m, adică de 43000 de ori mai mare decât diametrul acestuia, distanţă comparabilă cu distanţa dintre doi atomi dintr-un cristal. Astfel, un fascicul de electroni trimis către cristal va produce fenomenul difracţiei.
Mai multe despre dualitatea undă-particulă citiţi aici.
WERNER HEISENBERG ŞI PRINCIPIUL INCERTITUDINII
Heisenberg (1901-1976) şi-a adus contribuţia la o mai bună înţelegere a modelului cuantic al atomului prin teoria sa cunoscută sub numele de Principiul incertitudinii. Acest principiu spune - în esenţă - următoarele: în cazul unui electron (ori al unei particule de dimensiuni foarte mici) este imposibil de determinat cu precizie atât poziţia, cât şi impulsul (viteza) acestuia. Cu cât precizia de determinare a poziţiei creşte, cu atât precizia privind viteza scade şi invers.

Credit: www.tcd.ie
Acest lucru înseamnă că, în cazul electronului, ori nu-i ştim precis poziţia, ori nu ştim unde se va afla în viitor (pentru că nu-i ştim viteza cu exactitate). Ce rămâne de făcut? Să folosim statistica pentru a determina regiunile de probabilitate ale prezenţei electronilor. Nu este chiar ca în fizica clasică unde calculele ne permit să aflăm fără erori poziţia ori viteza unor obiecte, dar trebuie să ne obişnuim cu acest lucru, şi anume că mecanica cuantică, teoria care descrie lumea subatomică, funcţionează şi descrie lumea pe baza probabilităţilor.
ERWIN SCHRÖDINGER ŞI FUNCŢIA DE UNDĂ
Schrödinger (1887-1961) a gândit atomul ca un sistem tridimensional de unde. Ideea de orbită dispare din concepţia modului de funcţionare a atomului. Electronii sunt mărginiţi în anumite zone din jurul nucleului, mărginire ce survine în urma interacţiunilor dintre nucleu şi electroni.

Credit: www.chm.bris.ac.uk
Pornind de la ipoteza lui de Broglie şi cunoscând principiul incertitudinii al lui Heinsenberg, Schrödinger a scris în anul 1926 un set de ecuaţii - ori funcţii de undă - pentru a descrie electronul. Conform acestor ecuaţii electronii sunt distribuiţi în zone din jurul nucleului numite orbitali. Aceşti orbitali sunt asemenea unor nori; cu cât norul are o mai mare densitate, cu atât probabilitatea de a detecta un electron este mai mare.
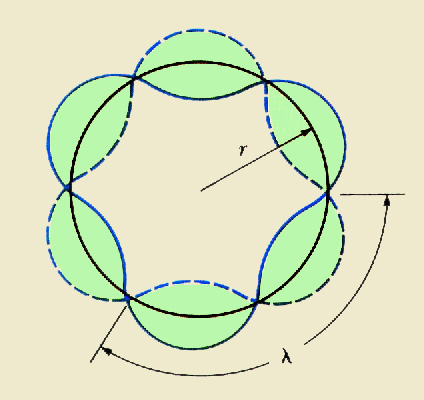
Schrödinger a interpretat în mod greşit soluţiile ecuaţiilor sale, crezând că undele reprezintă chiar electronii. Cel care a venit cu interpretarea corectă este Max Born, care a arătat că undele sunt în fapt probabilităţi, probabilitatea de a descoperi un electron într-un anumit loc.
Credit: media-2.web.britannica.com
Funcţia de undă a fiecărui electron poate fi descrisă ca un set de trei numere cuantice: numărul cuantic principal <n>, numărul cuantic unghiular (secundar) <l> şi numărul cuantic magnetic <ml>. Ulterior un al patrulea număr cuantic, spinul <ms>, a fost adăugat.
NUMERELE CUANTICE
Numărul cuantic principal, n: acesta descrie apartenenţa unui electron la un anumit nivel energetic. Poate lua valori de la 1 la infinit. Odată cu creşterea numărul cuantic principal, creşte şi energia electronului, iar orbitalii ocupă un spaţiu mai mare.
Numărul cuantic secundar, l: acestea descriu apartenenţa electronilor la un anumit subnivel.
Numărul cuantic magnetic, ml: descrie orientarea spaţială a orbitalilor; care identifică orbitalii în cadrul substraturilor, iar fiecare valoare a lui ml corespunde uneia din orientările permise pentru câmpul magnetic asociat orbitalului (pentru un substrat "p" - ml poate fi -1,0 sau 1, pentru un substrat "d", ml poate fi -2,-1,0,1 sau 2 etc.).
Numărul cuantic de spin, ms: descrie impulsul propriu de rotaţie al electronilor şi poate avea valorile +1/2 sau -1/2. Pe un orbital încap maxim 2 electroni, primul ocupant fiind de spin paralel (+1/2), iar al doilea, în mod obligatoriu, de spin opus.
WOLFGANG PAULI ŞI PRINCIPIUL EXCLUZIUNII

Credit: www.aip.org
Principiul excluziunii a fost formulat de Wolfgang Pauli (1900-1958) în 1925 şi afirmă că în învelişul electronic al unui atom nu pot exista doi electroni cu aceleaşi patru numere cuantice în acelaşi timp. Aşadar, pentru doi electroni identici, dacă numerele cuantice n, l şi ml sunt identice, ms, spinul, trebuie să fie diferit.
ORBITALII ATOMICI. TEORIE ŞI REPREZENTARE GRAFICĂ
Aşadar, mecanica cuantică nu mai priveşte electronii ca fiind în mişcare orbitală în jurul nucleului, aşa cum considera Niels Bohr, ci afirmă simplu că aceştia se află pe diverse niveluri energetice, fiind caracterizaţi de patru numere cuantice (citiţi în detaliu despre aceste numere cuantice aici).
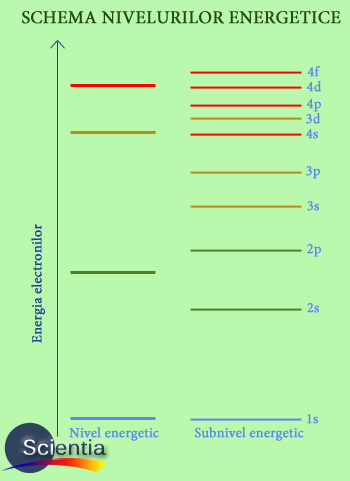
Electronii din învelişul electronic (spaţiul din jurul nucleului electronic în care se găsesc electronii atomului), funcţie de energia de care dispun, sunt ordonaţi pe niveluri energetice (straturi energetice). Straturile electronice sunt numerotate în funcţie de energie, crescător, numărul stratului fiind egal cu numărul cuantic principal, n. Nivelurile energetice se subîmpart în subniveluri care conţin un număr de orbitali.
Orbitalii reprezintă volumul din jurul nucleului atomic în care probabilitatea de a găsi un electron cu o anumită cantitate de energie este de 90%. Unui orbital îi pot fi atribuiţi maximum 2 electroni.
Aşadar, ştim că învelişul electronic al atomului este structurat pe niveluri energetice, care sunt împărţite pe subniveluri care conţin orbitali. Subnivelurile sunt notate cu s (de la eng.sharp), p (eng:principal), d (eng. diffus) şi f (eng.fundamental).
Numărul de orbitali ai subnivelurilor
Fiecărui subnivel îi este asociat un anume număr cuantic secundar l, astfel: subnivelul s are l=0, subnivelul p are l=1, subnivelul d are l=2 şi subnivelul f are l=3. Numărul de orbitali pentru fiecare subnivel se poate calcula cu formula: 2l+1. Aşadar, de pildă, subnivelul 2d are 2x2+1 orbitali, deci 5.
Cum se calculează numărul de electroni al fiecărui subnivel energetic?
După cum am arătam mai sus, fiecărui subnivel îi este asociat un anume număr cuantic secundar, l.
Formula de calcul a numărului maxim de electroni pe fiecare subnivel este următoarea:
Numărul maxim de electroni ai unui subnivel=4l + 2,
unde l este numărul cuantic secundar. Rezultă, aşadar, că pe subnivelul s avem maximum 2 electroni, pe subnivelul p avem maximum 6 electroni, pe subnivelul d avem maximum 10 electroni, iar pe subnivelul f avem maximum 14 electroni.
Cum se calculează numărul de electroni de pe fiecare nivel energetic?
Numărul maxim de electroni ai unui nivel energetic = 2 x n2,
unde n este numărul nivelului. Astfel, pe primul nivel vom avea maximum 2 electroni, pe nivelul 2 vom avea 2x22, adică 8, pe nivelul energetic numărul 3 vom avea 2x32, adică 18 şamd.
Iată acelaşi lucru pus sub formă tabelară:
| Nivel energetic |
Subnivel | ||
| Nr.nivel energetic |
Nr. maxim electroni | Denumire | Nr.maxim electroni |
| 1 | 2 | 1s | 2 |
| 2 | 8 |
2s |
2 6 |
| 3 | 18 | 3s 3p 3d |
2 6 10 |
| 4 | 32 | 4s 4p 4d 4f |
2 6 10 14 |
Care este logica ocupării orbitalilor cu electroni?
Distribuirea electronilor în învelişul electronic respectă trei principii: principiul lui Pauli (vezi mai sus explicaţia), principiul energetic şi regula lui Hund.
Principiul energetic spune că orbitalii sunt ocupaţi cu electroni în ordinea creşterii energiei.
Regula lui Hund afirmă că la ocuparea cu electroni a orbitalilor se ocupă mai întâi orbitalii care corespund unui subnivel cu câte un electron cu spin paralel, după care orbitalii se ocupă cu un al doilea electron de spin antiparalel.
Reprezentarea grafică a orbitalilor (selectiv)
Credit: Mark Winter (vezi aici mai multe imagini ale orbitalilor atomici)
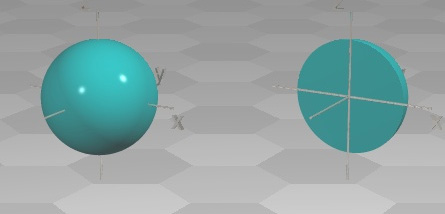
Orbitalul 1s - nivelul energetic nr.1
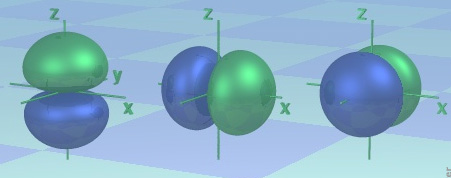
Orbitalul 2p - nivelulul energetic nr.2
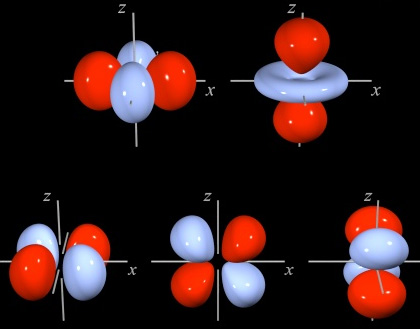
Orbitalul 3d - nivelul energetic nr.3
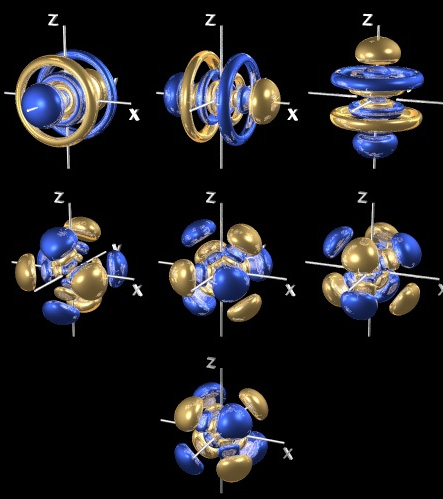
AŞADAR? CUM ARATĂ MODELUL CUANTIC AL ATOMULUI?
Se pare că natura este nedreaptă cu noi, căci în loc să avem un atom uşor de desenat, cu orbite ordonat puse în jurul nucleului atomic, forma norului de probabilităţi ale prezenţei electronilor în preajma nucleului este diferită de la atom la atom; ba, mai mult, în cadrul aceluiaşi atom putem găsi mai multe tipuri de orbitali, care înseamnă mai multe reprezentări grafice, ceea ce face imposibilă crearea unei imagini unice asupra modului în care electronii sunt distribuiţi sau - mai superficial spus - asupra modului în care atomul arată...
BIBLIOGRAFIE:
en.wikipedia.org/wiki/Atomic_orbital (lb.eng)
winter.group.shef.ac.uk/orbitron/AOs/1s/index.html(lb.eng)
www.neoam.cc.ok.us/~rjones/Pages/online1014/chemistry(lb.eng)
www.chem.ufl.edu/~itl/2045/lectures/lec_10.html (lb.eng)
