 Alchinele sunt hidrocarburile nesaturate care conţin în molecula lor o legătură triplă între doi atomi de carbon (─ C ≡ C ─). Formula generală a alchinelor este CnH2n-2. Citiţi în articolul de faţă o prezentare detaliată pe tema acestor compuşi organici.
Alchinele sunt hidrocarburile nesaturate care conţin în molecula lor o legătură triplă între doi atomi de carbon (─ C ≡ C ─). Formula generală a alchinelor este CnH2n-2. Citiţi în articolul de faţă o prezentare detaliată pe tema acestor compuşi organici.
Cu excepţia primului termen din seria omoloagă, acetilena, moleculele de alchine conţin atomi de carbon în două stări de hibridizare: sp3 si sp. Atomii de carbon care poartă legătura triplă sunt atomi hibridizaţi sp iar toţi ceilalţi sunt sp3 ca la grupa alcanilor. Seria omoloagă a alchinelor se obţine dând valori lui n în formula generală. Denumirea alchinelor se formează prin înlocuirea sufixului "-an" din alcanul respectiv cu sufixul "-ină".
Exemple:
HC ≡ CH etină (acetilena)
HC ≡ C ─ CH3 propină
HC ≡ C ─ CH2 ─ CH3 butină
HC ≡ C ─ CH2 ─ CH2 ─ CH3 pentină
Prezenţa triplei legături în molecula alchinelor determină apariţia izomerilor de poziţie, obţinuţi prin schimbarea locului legăturii triple din catena hidrocarbonată.
Exemple:
HC ≡ C ─ CH2 ─ CH3 (1 – butină)
H3C ─ CH ≡ CH ─ CH3 ( 2 – butină)
Metode de obţinere
1. Obţinerea acetilenei din metan
2CH4 -->C2H2 + 3H2 (la temperatura de 1500°C)
2. Obţinerea acetilenei din carbid
CaC2 + 2H ─ OH --> C2H2 + Ca(OH)2
Acetilena obţinută prin aceasta metoda se foloseşte la aparatele de sudură cu flacără oxiacetilenică.
Carbura de calciu este obţinută în prin reacţia oxidului de calciu cu cărbune:
CaO + 3C --> CaC2 + CO
Proprietăţi fizice
Acetilena, propina şi 1-butina sunt gaze, 2-butina şi termenii imediat următori sunt lichide, iar alchinele superioare sunt solide. Punctele de fierbere şi punctele de topire cresc odată cu creşterea masei moleculare.
Acetilena este un gaz incolor, fără gust, cu miros uşor eterat în stare pură, este solubilă în apă în proporţia 1:1 (părţi de volum). Este solubilă în solvenţi organici, solubilitatea crescând odată cu presiunea. Pentru a putea fi îmbuteliată, acetilena este introdusă în cilindri de oţel umpluţi cu un material poros (azbest), care împiedică propagarea unei explozii. Acesta se îmbibă cu acetona în care acetilena se dizolvă sub presiune.
Proprietăţi chimice
Factorul determinant al comportării chimice a acetilenei îl constituie tripla legătură. Aceasta, fiind formată dintr-o legătură sigma şi două legături pi conferă moleculei un caracter mai nesaturat decât dubla legătură.
I) Reacţiile de adiţie
Adiţia hidrogenului la acetilenă poate duce la etenă sau la etan, în funcţie de catalizatorii utilizaţi.
HC ≡ CH + H2 --> CH2 ═ CH2 (catalizator Pd otrăvit cu săruri de Pb )
CH ≡ CH + 2H2 --> CH3 ─ CH3 (catalizator Ni fin divizat )
Adiţia halogenilor: Adiţia bromului decurge după următoarea reacţie:
CH ≡ CH + Br2 --> CHBr ═ CHBr (1,2 – dibromoetenă)
CHBr ═ CHBr (1,2 – dibromoetenă) + Br2 --> CHBr2 ─ CHBr2 (1,1,2,2 – tetrabrometan)
Adiţia acizilor
Adiţia acidului clorhidric, în prezenţa clorurii de mercur (II) la temperaturi cuprinse între 120-170°C, adiţia conduce la clorura de vinil:
CH ≡ CH + HCl --> CH2 ═ CHCl
Acidul cianhidric adiţionează la acetilenă în prezenţa unui amestec de clorură de cupru (I) şi clorură de amoniu, formându-se cianura de vinil (acrilonitril).
CH ≡ CH + HCN --> CH2 ═ CH ─ CN
Toţi aceşti monomeri au proprietatea de a polimeriza uşor, formând polimerii respectivi. Ei au utilizări diverse la obţinerea maselor plastice, firelor şi fibrelor sintetice, lacurilor sintetice şi se produc în cantităţi mari.
Adiţia apei la acetilenă are loc într-o soluţie de acid sulfuric în prezenţa sulfatului de mercur. Intermediar se obţine alcool vinilic nestabil care izomerizează (prin fenomenul numit tautomerie) la acetaldehidă. Procedeul este cunoscut sub denumirea de reacţia Kucerov. Alcoolul vinilic şi acetaldehida sunt două substanţe izomere numite tautomere.
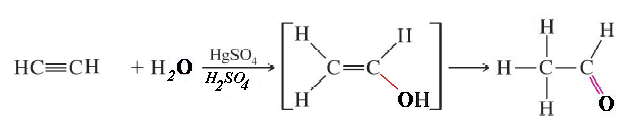
Reacţia Kucerov
Credit: Wikimedia Commons
II) Reacţii de oxidare:
Oxidată energic, acetilena arde cu degajarea unei cantităţi mari de căldură (3000°C). Procesul este utilizat la aparatul de sudură cu flacără oxiacetilenică (sudură autogenă).
C2H2 + 5/2 O2 --> 2CO2 + H2O + energie
- Cu agenţi oxidanţi slabi (soluţie de KMnO4) acetilena poate forma acid oxalic:
CH ≡ CH + 4[O] --> HOOC-COOH (acid oxalic)
III) Reacţii de substituţie:
Molecula de acetilenă are un caracter slab acid, deci va ceda uşor protonul în reacţie cu metalele sau cu substanţele cu caracter bazic, formând acetiluri.
a) Acetiluri ale metalelor din grupele principale I si II. Reacţia are loc la cald.
CH ≡ CH + Na --> CNa ≡ CH (acetilură monosodică)+ ½ H2
CNa ≡ CH (acetilură monosodică) + Na --> CNa ≡ CNa (acetilură disodică )+ ½ H2
b) Acetilurile metalelor tranziţionale se obţin ca precipitate în soluţie prin reacţia dintre acetilenă şi o sare complexă solubilă a metalului respectiv.
Să luăm ca exemplu obţinerea acetilurii de Ag:
CH ≡ CH + 2[Ag(NH3)2OH] (hidroxid diamino Ag) --> C Ag+ ≡ Ag + (acetilura de argint) + 4NH3 (amoniac) + 2H2O (apă)
Bibliografie: manualele alternative de chimie pentru clasa a X-a.