Legăturile metalice sunt legături chimice ce se formează între atomii metalelor, cum ar fi magneziul (Mg), sodiul (Na) sau cuprul (Cu). Cea mai simplă teorie ce explică legăturile metalice spune că atomii metalelor cedează electronii de pe ultimul strat, pentru a forma cationi.
Aceşti cationi sunt aşezaţi în straturi, straturile fiind aşezate unele peste altele. Electronii cedaţi de atomii metalelor sunt liberi în interiorul structurii. Astfel, legătura metalică este atracţia electrostatică dintre ionii pozitivi, care sunt ficşi şi electronii (cu sarcină electrică negativă) care se mişcă continuu printre ioni.
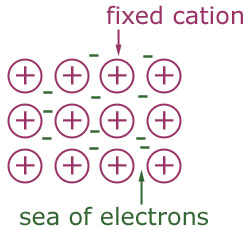
credit imagine: http://scienceaid.co.uk
Imagine ce exemplifică legătura metalică. Ionii pozitivi sunt ficşi în interiorul structurii, în timp ce electronii sunt liberi să se mişte în interiorul ei. Aceştia formează o ”mare de electroni”.
Sunt mai multe elemente ce influenţează cât de rezistentă este o legătură metalică. Printre acestea sunt: sarcina ionului, sarcină ce e egală cu numărul de electroni cedaţi şi raza metalică.
Cu toţii ştim că metalele sunt bune conductoare de electricitate. Asta se întâmplă din cauza electronilor care sunt liberi să se mişte în interiorul structurii.
