Legătura ionică este un tip de legătură chimică. Haideţi să vedem, pentru început, ce sunt ionii. Un ion este un atom, o moleculă sau un grup de atomi ce nu este neutru din punct de vedere electric. De exemplu, un atom care primeşte un electron devine ion negativ, iar un atom care cedează un electron devine ion pozitiv.
Legătura ionică este definită ca fiind atracţia electrostatică dintre ioni cu sarcini opuse. De cele mai multe ori se formează între metale şi nemetale, prin transfer de electroni.
Exemplu: Un atom de magneziu (Mg) cedează doi electroni, devenind Mg2+. Cei doi electroni sunt acceptaţi de un atom de oxigen, acesta devenind O2-. Cum speciile de semn opus se atrag, se formează o legătură între cei doi ioni, rezultând oxidul de magneziu, MgO. Acest tip de legătură se numeşte legătură ionică, ea formându-se între doi sau mai mulţi ioni.
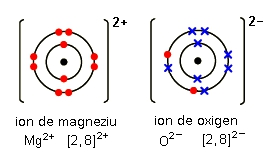
Astfel se reprezintă, printr-o diagramă, legătura ionică din molecula de oxid de magneziu. Cruciuliţele reprezintă electronii atomului de oxigen, iar punctele sunt electronii atomului de magneziu. Se pot vedea, în structura ionului de oxigen, cei doi electroni acceptaţi de la atomul de magneziu.
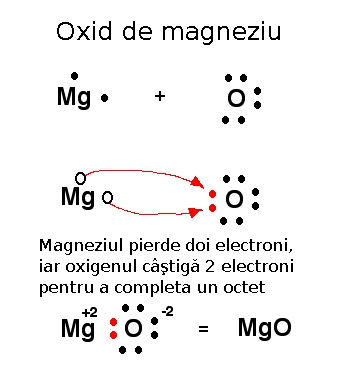
În această imagine este reprezentată tot formarea oxidului de magneziu, de această dată cu săgeţi ce indică mişcarea electronilor. Sunt arătaţi prin puncte doar electronii de pe ultimul strat.

Astfel arată oxidul de magneziu, ca o pudră albă
credit imagine: http://www.redbestoffers.com
Nu există legătură perfect ionică. În rândurile următoare vă voi explica de ce, folosind ca exemplu de data aceasta molecula de LiCl, clorura de litiu. Cum, pentru a avea o configuraţie stabilă de gaz rar, litiul cedează un electron, devenind Li+, iar clorul acceptă un electron, devenind Cl-, este normal să vă gândiţi că formează o legătură ionică. Ei bine, da şi nu.
Ionii pozitivi sunt mai mici decât atomii elementului din care s-au format, în timp ce un ion negativ este mai mare decât atomul iniţial. În acest exemplu, Li+ este mult mai mic decât Cl-. Altfel, el are tendinţa de a distorsiona norul electronic al ionului de clor şi de a atrage electronii spre el. Ionii nu sunt astfel perfect sferici, iar transferul de electroni nu se face complet. Între cei doi ioni există o zonă cu densitate electronică diferită de zero. Altfel spus, există electroni pe care cei doi ioni îi ”împart”. Spunem că legătura dintre ei este parţial ionică, ea având şi caracter covalent. Legătura covalentă o vom discuta într-un alt articol.
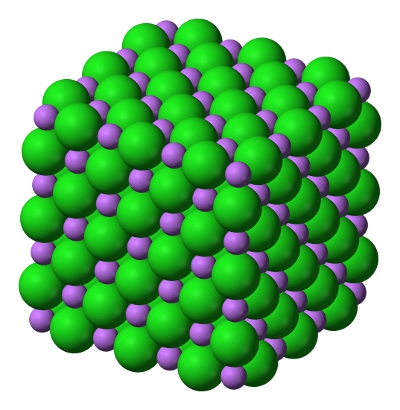
Imagine ce prezintă structura clorurii de litiu. Bilele verzi reprezintă ionii de clor, iar cele mov ionii de litiu. Se poate observa că ionii de litiu sunt mult mai mici comparativ cu cei de clor.
credit imagine: Wikimedia Commons
Acestea fiind spuse, vă invit să vă gândiţi de ce legătura dintre MgS (sulfura de magneziu) are un caracter ionic mai puţin pronunţat decât legătura din NaF (fluorură de sodiu).
Indiciu: Ionii sunt mai mici cu cât sarcina este mai mare. Raza ionică creşte în josul unei grupe.
