În ultimii ani, CRISPR a fost prezent adesea în mass-media. Experții prezic că această tehnologie de editare genetică va transforma planeta, schimbând radical societatea umană. În comparație cu alte instrumente utilizate pentru ingineria genetică, CRISPR (cunoscut și sub denumirea mai tehnică, CRISPR-Cas9) este precis, ieftin, ușor de utilizat și remarcabil de puternic.
Descoperit la începutul anilor '90 și folosit pentru prima dată în experimente biochimice șapte ani mai târziu, CRISPR (Clustered regularly-interspaced short palindromic repeats) a devenit rapid printre cercetători cel mai popular instrument de editare genetică în domenii precum biologia umană, agricultură și microbiologie.
Oamenii de știință se află încă în primele etape ale stabilirii modului în care putem folosi CRISPR pentru a schimba lumea. Desigur, puterea de a modifica ADN-ul - codul sursă al vieții - aduce cu ea numeroase întrebări și preocupări etice. Având în vedere acest lucru, iată câteva dintre cele mai interesante utilizări pentru această tehnică revoluționară și obstacolele care ar putea încetini sau împiedica această tehnologie să-și atingă întregul potențial.
În fapt, tehnologia CRISPR a fost identificată în natură, nu descoperită de savanţi. Microbii o folosesc pentru a-şi edita propriul ADN de milioane de ani. Pe scurt, mecanismul CRISPR la nivelul microbilor este următorul:
În ADN-ul bacteriilor există anumite secvențe palindromice repetitive (CRISPR) între care sunt memorate secvențe de virusuri. În momentul în care o bacterie este infectată cu un virus care a fost deja memorat în secvențele repetitive CRISPR, un complex molecular al bacteriei elimină virusul proaspăt integrat în ADN-ul acesteia. CRISPR este practic sistemul imunitar specific (adaptiv) al bacteriilor. În ultimii 20 de ani cercetătorii au exploatat sistemul CRISPR, l-au adaptat de la bacterii la celulele mamiferelor, altfel încât el poate fi folosit pentru a detecta orice secvență ADN de interes și o poate elimina dintr-un genom.
1. CRISPR ar putea corecta erorile genetice care provoacă boli
Cardiomiopatia hipertrofică (HCM) este o afecțiune cardiacă care afectează una din 500 de persoane din întreaga lume. Simptomele sale sunt dureroase, iar uneori boala este letală. Mutațiile dintr-un număr de gene dominante determină întărirea țesuturilor inimii, ceea ce poate duce la dureri în piept, slăbiciune și, în cazuri grave, stop cardiac.
Datorită progreselor medicale recente, speranța medie de viață a unei persoane cu HCM este apropiată de media populației, dar această afecțiune poate duce la situații care pot pune viața în pericol dacă este lăsată netratată.
Dar într-o zi s-ar putea să putem folosi editarea genetică pentru a vindeca această boală odată pentru totdeauna.
În vara anului 2017, oamenii de știință de la Oregon Health and Science University au folosit CRISPR pentru a șterge una din aceste gene defecte într-un număr de embrioni umani viabili. Rezultatele au fost promițătoare: dintre cei 54 de embrioni injectați cu CRISPR-Cas9 la 18 ore după fertilizare, 36 nu au prezentat nici o mutație a genei (practic probabilitate zero de a avea boala), iar 13 au prezentat unele mutații, cu o probabilitate de 50% de moștenire a HCM.
Mutațiile genetice nedorite și mozaicul genetic (doar o parte din celulele unui organism adoptă modificările, ceea ce înseamnă că o parte din urmași ar moșteni mutația) au fost prezente la doar 13 din cei 54 de embrioni.
Pentru a reduce în continuare probabilitatea ca numai câteva celule să fie modificate, cercetătorii au efectuat un alt experiment în care au corectat aceeași genă în embrioni în momentul fertilizării. Ei au descoperit că doar unul a prezentat mozaic genetic - un rezultat impresionant, studiul fiind mult mai eficient decât studii similare mai vechi (de exemplu, în cadrul unui studiu clinic din 2015 în China nu s-a reușit să se elimine mozaicul genetic).
''Folosind această tehnică este posibil să se reducă incidența acestei boli ereditare asupra familiei și în cele din urmă asupra populației umane'', a declarat Shoukhrat Mitalipov, autorul principal al studiului și cercetător la Universitatea Oregon de Sănătate și Știință, într-un comunicat de presă. Eliminarea mutației în primele etape ale dezvoltării embrionare va reduce sau elimina necesitatea tratamentului mai târziu în viața pacientului.
În timp ce unii oameni de știință specializați în celule stem au pus la îndoială faptul că aceste zeci de mutații ar fi realmente eliminate, studiile efectuate i-au ajutat pe oamenii de știință să înțeleagă mai bine eficacitatea CRISPR. Mai mult, unul dintre coautorii studiului HCM și-a exprimat deja interesul de a aplica aceeași tehnică asupra unor mutațiilor genetice (BRCA1 și 2) care cresc riscul de cancer mamar.
Acestea fiind spuse, oamenii de știință știu că modificarea codului genetic în embrionii umani ar putea avea consecințe neintenționate. Ce se întâmplă dacă CRISPR face schimbări în locul greșit și modifică sau elimină neintenționat gene sănătoase? Cum ar putea fi afectat pacientul?
În unele părți ale lumii, cum ar fi China, oamenii de știință pot experimenta pe embrioni umani fără prea mari constrângeri. Dar acest lucru nu este posibil în Statele Unite, Canada sau în Regatul Unit, de pildă.
În SUA Administrația pentru Alimentație și Medicamente (FDA) nu în calcul pentru moment utilizarea fondurilor publice pentru studii care modifică genele ce pot fi moștenite (embrionii din studiul cercetătorilor din Oregon nu au fost destinați utilizării ulterioare, iar finanțarea cercetării a fost privată).
În Canada, editarea de gene care pot fi transmise generațiilor viitoare este infracțiune, cu o pedeapsă maximă de zece ani în închisoare.
Între timp, în Marea Britanie, Autoritatea de Embriologie și Fertilizare Umană a acordat unei echipe de oameni de știință din Londra licența necesară pentru a putea edita gene în embrionii umani în 2016. Oamenii de știință din Marea Britanie speră că acest lucru va crea un precedent și va menține ușa deschisă pentru acțiuni similare în viitor.
2. CRISPR poate elimina microbii care provoacă boli
Deși tratamentele împotriva HIV au transformat radical impactul bolii, SIDA fiind o afecțiune cu care se poate trăi (spre deosebire de trecutul recent când SIDA era aproape echivalentă cu decesul), oamenii de știință încă nu au găsit un leac. Aceasta s-ar putea schimba cu CRISPR. În 2017, o echipă de cercetători chinezi a crescut rezistența șoarecilor la HIV prin replicarea mutației unei gene care previne în mod eficient intrarea virusului în celule.
Deocamdată oamenii de știință efectuează aceste experimente doar pe animale, dar există motive să se creadă că aceleași metode ar putea funcționa la om. Mutația care încurajează rezistența la HIV apare în mod natural la un procent mic de oameni. Prin utilizarea CRISPR pentru a introduce mutația în celulele stem umane care nu o au, cercetătorii ar putea îmbunătăți substanțial rezistența la HIV în viitor.
Un alt studiu de editare genetică va începe în China în iulie 2018 și va încerca să utilizeze CRISPR pentru a afecta genele papilomavirusului uman (HPV) - un virus care s-a dovedit a provoca tumori canceroase pe colul uterin - distrugându-l efectiv.
Într-o abordare ușor diferită, oamenii de știință din Carolina de Nord au folosit CRISPR pentru a modifica bacteriofagi (un tip de virus care infectează și se duplică în interiorul unei bacterii) și pentru a-i folosi pentru a ucide bacterii nocive. Din anii '20 bacteriofagii au fost utilizați în studii clinice pentru a trata infecțiile bacteriene. Dar recoltarea acestora din natură s-a dovedit a fi dificilă, insuficienta informație la acea vreme a făcut ca rezultatele utilizării lor să fie imprevizibile, iar creșterea pieței antibioticelor a făcut ca utilizarea lor să devină nepopulară.
Chiar și astăzi, unii cercetători se tem că inundarea corpului cu un volum mare de bacteriofagi poate declanșa reacții imune sau poate determina bacteriile rezistente la antibiotice să devină de, asemenea, rezistente la bacteriofagi.
Cu toate acestea, în timp ce studiile pe om încă nu se efectuează, cercetătorii sunt optimiști cu privire la utilizarea CRISPR pentru a modifica bacteriofagi, deoarece folosirea acestora reprezintă o metodă eficientă, sigură pentru tratarea infecțiilor bacteriene. De fapt, în cadrul unui studiu efectuat în anul 2017 cercetătorii au reușit să salveze viețile unor șoareci infectați cu infecții rezistente la antibiotice utilizând bacteriofagi modificați prin CRISPR.
3. CRISPR ar putea resuscita specii
În februarie 2017, geneticianul George Church, Universitatea Harvard, a făcut un anunț surprinzător în fața reuniunii anuale a Asociației Americane pentru Progresul Științei. El a afirmat că echipa sa este la doar doi ani distanță de crearea unui embrion pentru un hibrid elefant-mamut.
Church speră că aducerea înapoi a mamutului lânos ar putea ține sub control încălzirea globală. "[Mamuții] blochează dezghețarea tundrei prin găurirea stratului de zăpadă, permițând astfel aerului rece să pătrundă la nivelul solului".

Mamut lânos. Imagine: wikipedia.org
Church și echipa sa speră să utilizeze CRISPR pentru a combina materialul genetic de la elefantul asiatic (o specie pe cale de dispariție, care ar putea fi salvată) și mamutul lânos. Mostrele de la cel din urmă au fost recoltate din ADN-ul din bile de păr înghețate găsite în Siberia. Prin adăugarea genomului mamutului la cel al elefantului asiatic, organismul care rezultă ar avea caracteristici comune mamutului lățos, cum ar fi blana lungă, care ar servi ca izolație în climatul rece. Obiectivul este de a implanta acest embrion hibrid într-un elefant.
Rezultatele sunt promițătoare, dar mulți experți consideră că planificarea lui Church este puțin prea optimistă. Chiar dacă cercetătorii ar avea un embrion hibrid funcțional, dezvoltarea acestuia în interiorul unui uter artificial, așa cum sugerează Church, va reperzenta un alt obstacol important.
În mod cert, laboratorul lui Church este deja capabil să asigure dezvoltarea unui embrion de șoarece în interiorul unui uter artificial pentru jumătate din perioada de gestație, aproximativ 10 zile. Dar asta nu garantează că vom fi martori la nașterea unui hibrid elefant-mamut în următorii ani.
4. CRISPR ar putea crea noi alimente, mai sănătoase
Editarea genetică prin CRISPR s-a dovedit a fi promițătoare în domeniul cercetării agricole. Cercetătorii de la Cold Spring Harbor Laboratory din New York au folosit CRISPR pentru a crește randamentul roșiilor. Laboratorul a creat o metodă de editare a genelor care determină dimensiunea roșiilor, ramificația plantei și, în cele din urmă, forma plantei pentru o recoltă mai bună.

Editarea structurii plantei duce la recolte mult mai bune. Imagine: Cold Spring Harbor Laboratory
"Fiecare trăsătură poate fi acum controlată similar modului în care un potențiometru controlează un bec", a declarat Zachary Lippman, profesor și cercetător principal la Cold Spring Harbor, într-un comunicat de presă. "Acum putem lucra cu ADN-ul original și putem îmbunătăți ceea ce a oferit natura, ceea ce credem că poate ajuta la creșterea randamentului".
Culturile cu randament ridicat pentru a hrăni populația globului sunt doar începutul; oamenii de știință speră ca tehnologia CRISPR să ajute la eliminarea stigmatizării organismelor modificate genetic (OMG). În 2016, compania de tehnologie agricolă DuPont Pioneer a anunțat o nouă varietate de porumb editat cu CRISPR, care, ca urmare a modului în care cercetătorii au modificat genele, nu este din punct de vedere tehnic OMG.
Distincția dintre OMG și culturile modificate genetic este destul de simplă. OMG-urile tradiționale sunt realizate prin introducerea unor secvențe ADN străine în genomul unei culturi, transmițând astfel noi trăsături sau caracteristici viitoarelor plante. Editarea genelor este mai precisă: efectuează modificări precise ale genelor în anumite zone ale genomului original, adesea eliminând anumite gene sau schimbând poziția acestora, toate fără a introduce ADN străin.
În timp ce OMG-urile au fost controversate în rândul consumatorilor, companii precum DuPont Pioneer speră că produsele alimentare produse prin editarea genetică vor fi mai bine primite. În deceniile în care OMG-urile au fost disponibile pe piața americană oamenii de știință nu au detectat niciun risc pentru sănătate, dar chiar și cei mai mari susținători ai OMG admit că oamenii de știință încă nu cunosc toate riscurile pe termen lung. Același lucru este valabil și pentru culturile editate cu ajutorul CRISPR. Bineînțeles, oamenii de știință vor continua să testeze și să evalueze aceste culturi pentru a se asigura că nu există efecte secundare neașteptate; partea bună este că cercetările actuale au rezultate foarte promițătoare. În cele din urmă, culturile editate genetic cu ajutorul CRISPR vor inunda probabil piețele globale.
DuPont Pioneer speră să introducă pe piața americană porumbul editat genetic până în 2020. O ciupercă editată genetic a fost deja aprobată de Departamentul Agriculturii din SUA, deoarece nu conține ADN străin de la viruși sau bacterii, devenind primul organism editat cu tehnologia CRISPR, acceptat pentru uz uman. Suedia a declarat deja că va clasifica și reglementa culturile modificate prin CRISPR în mod diferit decât OMG-urile, dar Comisia Europeană nu a exprimat deocamdată o poziție.
5. CRISPR ar putea elimina molime
Tehnicile de editare genetică, precum CRISPR, ar putea combate în mod direct bolile infecțioase, dar unii cercetători au decis să încetinească răspândirea bolii prin eliminarea mijloacelor sale de transmitere. Oamenii de știință de la Universitatea din California, Riverside, au creat un țânțar care este susceptibil la modificări operate cu ajutorul CRISPR, oferind oamenilor de știință un control fără precedent asupra trăsăturilor pe care organismul le transmite urmașilor. Rezultatul: țânțari galbeni, cu trei ochi și fără aripi, creați prin modificarea genelor responsabile pentru dezvoltarea ochilor, aripilor și a cuticulei.
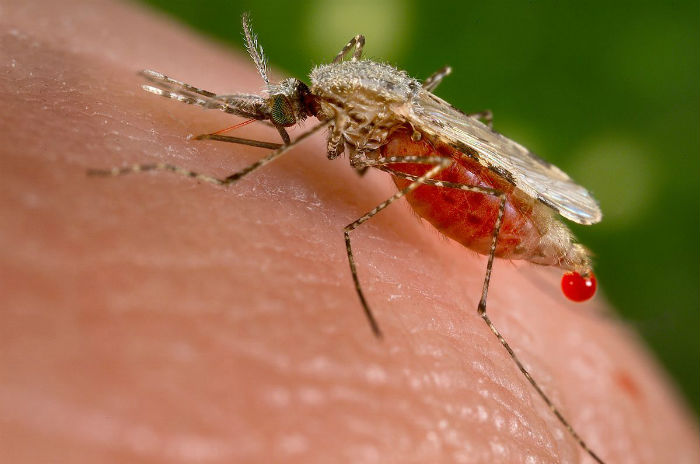
Țânțarul anofel, purtător al malariei. Imagine: Wikimedia Commons
Prin modificarea genelor dorite la țânțari, echipa testează un sistem "gene drive" pentru a răspândi aceste caracteristici inhibitoare. ''Gene drive'' reprezintă o modalitate prin care se asigură că o trăsătură genetică este favorizată și va fi moștenită de generațiile viitoare. Prin afectarea zborului și vederii țânțarilor, echipa Riverside speră să reducă mult capacitatea de a răspândi boli infecțioase periculoase printre oameni, cum ar fi febra Dengue și febra galbenă.
Alți cercetători elimină populațiile de țânțari acționând asupra modului în care se reproduc. La Colegiul Imperial din Londra, în 2016, o echipă de cercetători a utilizat CRISPR pentru a afecta reproducerea țânțarului care poartă și transmite malaria, printr-un sistem gene drive care a făcut ca sterilitatea să se transmită la generațiile următoare.
Dar ''jocul'' cu populațiile de țânțari poate avea consecințe neprevăzute. Eliminarea unei specii, chiar și a uneia care nu pare să aibă o valoare ecologică foarte mare, ar putea strica echilibrul fragil al ecosistemelor existente. Aceasta ar putea avea consecințe dezastruoase, cum ar fi creșterea riscului ca bolile precum malaria să poată fi transmise de specii diferite.
CRISPR în viitor
Progresele științifice actuale arată că CRISPR nu este doar o tehnologie extrem de versatilă, ci una care se dovedește a fi precisă și din ce în ce mai sigură de utilizat. Dar trebuie să se facă încă multe progrese; abia începem să vedem adevăratul potențial al instrumentelor de editare a genomului, cum ar fi CRISPR-Cas9.
Dificultăți tehnologice și de natură etică stau între noi și un viitor în care hrănim planeta cu alimente editate genetic, eliminăm afecțiuni de natură genetică sau reîntoarcem la viață specii dispărute de animale. Dar suntem pe drumul cel bun...
Un articol amplu dedicat CRISPR (însoţit de explicaţii video) poate fi citit aici: Cum funcţionează tehnologia CRISPR
Sursa: Futurism
